| 图片: | |
|---|---|
| 名称: | |
| 描述: | |
- 2014年第25期(总第104期)——左乳肿物(已点评)
-
ilifeimoney 离线
- 帖子:3
- 粉蓝豆:17
- 经验:63
- 注册时间:2014-04-21
- 加关注 | 发消息
转发张祥盛老师老师的精彩点评!
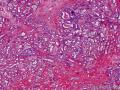
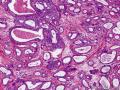
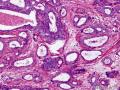
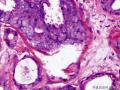
本例最终诊断为高分化浸润性导管癌。小管状乳腺病变非常常见,而鉴别诊断有时非常困难,真可谓良恶难辨,具有挑战性。本例阅读人数达3575人次,回复72人次,提出的诊断达10种之多。可以说讨论非常热烈!谢谢网友的积极参与。
2012年WHO乳腺肿瘤分类将浸润性导管癌(非特殊类型)改称为浸润性癌(非特殊类型)。按Nottingham组织学分级方案,根据所含小管或腺体的数量、核的多形性程度和核分裂象计数三项综合记分,将浸润性导管癌分为3级。1级(高分化)3~5分, 2级(中分化)6~7分, 3级(低分化)8~9分。单纯以腺管形成为特点的高分化浸润性导管癌较为少见,但在活检切取的小标本或粗针穿刺标本内主要出现高分化(腺管型)浸润性导管癌的情况是可能遇到的。当这种情况出现时,病理医师面临着高分化(腺管型)浸润性导管癌与微腺性腺病、小管癌甚至硬化性腺病进行鉴别的问题,有时会遇到困难。
高分化(腺管型)浸润性导管癌临床上和巨检与其他浸润性癌无明显不同,镜检由大小不等、形状不一的腺管状成分组成,其腺管开放,呈圆形、椭圆形或不规则形,亦可成尖角状腺管,其外轮廓线平滑均匀,无肌上皮层及基膜。腺管多由腺上皮组成,可仅为单层细胞,也可2-3层,但多数有微灶性复层上皮灶。细胞呈立方形-柱状,胞质嗜酸性,多无胞突,也可出现胞突。胞核常有中-高度异型(中-高核级),常见核仁,核分裂多少不等。间质成分多样,可为促纤维增生性间质,也伴不等量胶原纤维, 亦可有灶性弹力纤维增生,尤多见于导管或小静脉周围。相当多的病例中,可见导管内癌与浸润性导管癌同在。
弹力纤维染色显示间质的胶原纤维间,尤其在导管或小静脉周围,见细密的弹力纤维增生。免疫组化染色ER、PR常阳性,部分病例HER-2阳性,肌上皮标记物(如SMA、p63 、calponin、CD10等)阴性。
鉴别诊断
1. 小管癌:由于小管癌的预后比高分化浸润性导管癌的预后好,因此两者的鉴别非常重要。一般而言,高分化浸润性导管癌的腺管比较大,大小形状更不规则,较少出现卵圆形、尖角状腺管。腺管可衬覆单层细胞,但常缺乏胞突(可有胞突),腺管亦常被覆两层或多层细胞,核级别较小管癌高,多形性及异型性更明显,核分裂多,腺管之间的间质内可有小巢状、簇状、甚至单个浸涧的癌细胞。如果病变内有高核级的导管内癌 (特别是粉刺型)或小腺管之间出现分化差的癌存在时,基本可以排除小管癌。小管癌是一种预后好的特殊类型浸润性癌,肿瘤小(直径多在1cm左右),淋巴结转移率低,极少有死亡者。组织学从某一局部区域鉴别两者有时是很困难的。免疫组化染色,ER、PR阴性或HER2(3+)时,诊断小管癌要慎重,小管癌一般ER、PR总是阳性,HER2总是阴性。本例的组织学特点和免疫组化结果均符合高分化浸润性导管癌。
2. 混合性小管癌:癌组织由浸润性导管癌(非特殊类型)及小管癌混和组成,达不到诊断单纯性小管癌的标准。浸润性筛状癌与小管癌混合性癌,是两种特殊类型癌的混合性癌,因其预后较好,应和前者区分。
3. 具有小管状结构的良性病变:包括放射状硬化性病变,小管状腺病、微腺性腺病、硬化性腺病及小管状腺瘤等,其鉴别需结合组织结构、细胞学特征及免疫组化表型,进行全面分析。特别是上述良性病变硬化性间质内的增生腺体受挤压扭曲变形时,鉴别会遇到困难,常要借助免疫组化染色辅助诊断。对免疫组化染色结果的判读,是否存在肌上皮,CK5/6是阳性还是阴性,是鉴别良恶性(真假浸润)腺管的一个重要指标,但绝不能仅凭肌上皮缺失和/或CK5/6阴性诊断恶性,一定要结合传统组织形态学改变。微腺性腺病是一种少见的缺乏肌上皮(但有基膜)的良性病变,CK5/6也不一定阳性,其小腺管圆而一致,衬覆细胞无异型性。放射状硬化性病变中央瘢痕区内扭典变形的腺体和小管亦可缺乏肌上皮及CK5/6阴性。值值得注意的是,肌上皮标记物及CK5/6阴性并不是诊断浸润性癌唯一指标,诊断癌的最重要指标是细胞学上应具有异型性,另外,还要注意病变所处的位置。
推荐本例的获奖者为:xinzhu1492

- Stop walking today and you'll have to run tomorrow.