| 图片: | |
|---|---|
| 名称: | |
| 描述: | |
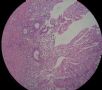
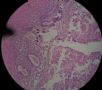
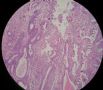
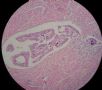
- B494UPSC1例
| 姓 名: | 患者 | 性别: | 女 | 年龄: | 67 |
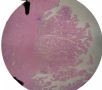
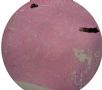
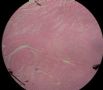
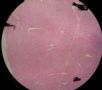
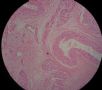
| 标本名称: | 宫腔内肿瘤 | ||||
| 简要病史: | 绝经20年,阴道出血 | ||||
| 肉眼检查: | 宫腔内小乳头状肿块,切面未见明显肌层浸润 | ||||
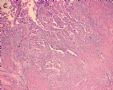
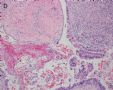
1 2 3 4
5 6 7 8
9 10 11 12
13 14 15 16
17 18 19 20
图1为全貌。图2-7显示浅肌层。图7-10显示深肌层。图11-14显示近浆膜面肌层。图15为图3的局部放大。图16为图5和图6的局部放大。图17为图7的局部放大。图18为图12的局部放大。图19为图11的局部放大。
-
本帖最后由 于 2006-12-15 12:33:00 编辑

华夏病理/粉蓝医疗
为基层医院病理科提供全面解决方案,
努力让人人享有便捷准确可靠的病理诊断服务。
相关帖子
- • 来一例简单罕见的(有诊断)
- • 是肉瘤吗?
- • 子宫内膜,复杂性增生?癌?(有大体结果了)
- • 子宫肿物(透明细胞平滑肌瘤?)
- • 子宫肌壁间肿物
- • 子宫腔内占位。
- • 子宫肿瘤
- • 子宫肌层浸润性癌
- • 8 个子宫上皮肿瘤病例-扫描图片
- • 子宫平滑肌肿瘤?间质肉瘤?
-
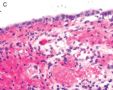
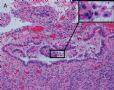
FIG. 3. Endometrial glandular dysplasia glands on the surface of atrophic endometrium in case 3. The endometrial biopsy sample showed several strips of atrophic endometrium. One piece of the atrophic endometrium contained 2 foci of EmGD with 1 on the surface (A with arrow). One piece of them showed 2 foci of EmGD with 1 on the surface (A with arrow) and the other showed 2 small papillary fronds (in the center of Fig.

华夏病理/粉蓝医疗
为基层医院病理科提供全面解决方案,
努力让人人享有便捷准确可靠的病理诊断服务。
-
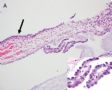
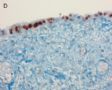
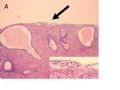
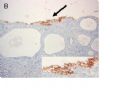
FIG. 1. Endometrial biopsy 16 months before hysterectomy in case 1. Focal areas of EmGD lining on the surface of an otherwise unremarkable endometrial polyp were seen (A, arrow). Mild-to-moderate degree of atypia of the EmGD cells was better appreciated in a high-power view (insert in the upper right corner of A). Immunohistochemistry of p53 staining (B and a magnified picture in the insert) highlighted the EmGD cells with a score of 7 (percentage 2, intensity 3, and heterogeneity 2). The resting endometrial glands within the endometrial polyp in Figure

华夏病理/粉蓝医疗
为基层医院病理科提供全面解决方案,
努力让人人享有便捷准确可靠的病理诊断服务。
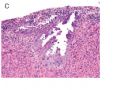
FIG. 2. Endometrial glandular dysplasia glands in an endometrial polyp of case 2. The endometrial biopsy was performed 17 months before the hysterectomy. Figure

华夏病理/粉蓝医疗
为基层医院病理科提供全面解决方案,
努力让人人享有便捷准确可靠的病理诊断服务。
-
本帖最后由 于 2007-05-09 22:34:00 编辑
Uterine Papillary Serous Carcinoma
E. Cagnur Ulukus, M.D., John R. Davis, M.D., and Setsuko K. Chambers, M.D.
很抱歉由于版权问题,不能引用全文。以下各图均引自此文,谨向郑文新老师(Wenxin Zheng, M.D.)致谢!感谢wangzhen_01提供资料!
zhjjwf 译:
子宫内膜腺体不典型增生先于子宫浆液性乳头状癌的出现
摘要:子宫内膜腺体不典型增生(EmGD)是一个新的概念体系,它通常与浆液性子宫内膜上皮内癌和子宫内膜浆液性乳头状癌(UPSC)有特定的联系.有人建议将子宫内膜腺体不典型增生看作UPSC的一种真正的癌前病变,根据我们最近的研究显示两者在形态学和分子水平有关联。本研究应用回顾性研究方式,通过观察它们的临床病理特征,以检测是否EmGD出现在UPSC发展之前,并界定从EmGD的出现到充分发展为UPSC的时期。250例UPSC 和258例良性病例被用于本次研究。为了鉴定是否EmGD 出现在UPSC 之前,我们重新观察了所有可得到的子宫切除前3个月或更早的子宫内膜活检标本。这包括来自UPSC的27例活检标本和29例良性对照组的标本。那些在子宫内膜形态学上异常,与原来活检时的诊断一致且符合EmGD的病例,将被记录下来。在所有子宫切除前的内膜活检标本中,我们在形态学上确诊为EmGD的共10例;包括27例UPSC组中的9例(33%),29例良性对照组中的1例。除1例来自UPSC组未进行检测和1例来自良性对照组的得分为0分外,10例形态学上诊断为EmGD的病例均显示p53染色的高得分(5分)。
所有EmGD病例均表现为高MIB-1指数,但形态上表现为良性的病例则为低的MIB-1指数。本研究的主要目的是回顾性地研究这些确诊为EmGD的病例。从确诊为EmGD到出现子宫内膜上皮内浆液性癌或完全发展为UPSC的时间为16到98个月,平均为33个月。我们得出结论,EmGD的出现早于UPSC的发生。这一发现支持了我们最近提出的UPSC发展模型建议,这一模型认为EmGD很可能是UPSC的癌前病变。更深入的研究需要集中探讨其分子及细胞学机制、可逆性和UPSC发展的危害和EmGD的临床处理。

华夏病理/粉蓝医疗
为基层医院病理科提供全面解决方案,
努力让人人享有便捷准确可靠的病理诊断服务。
-
本帖最后由 于 2007-03-19 19:35:00 编辑
| 以下是引用yifan 在2007-3-10 16:14:00的发言: 请问abin:有EmGD、SEIC及EIN的典型图吗?谢谢! |
最近仔细复习了我收集的UPSC病例,发现1例发生于子宫内膜息肉的UPSC,是否可以认为SEIC,还要进一步学习。等等上传。
此例深肌层内已有累犯,不应认为SEIC。但是,宫腔内小乳头状肿物,镜下UPSC未浸润肌层(UPSC与肌层之间可见明显的良性腺体和间质),若从学习角度把深肌层浸润忽略,仍可认为SEIC。
不知这样理解对不对?请老师们指正。

华夏病理/粉蓝医疗
为基层医院病理科提供全面解决方案,
努力让人人享有便捷准确可靠的病理诊断服务。
子宫乳头状浆液性癌的前驱病变及其临床处理研究进展
摘要:子宫乳头状浆液性癌(uterine papillary serous carcinoma, UPSC)属于非雌激素相关型子宫内膜癌(II型),预后差。有关其前驱病变的研究很多,命名混乱,浆液性子宫内膜上皮内癌(serous endometrial intraepithelial carcinoma, SEIC)在WHO新分类中被称为“一种假定的前驱病变”。新近研究认为子宫内膜腺体异型增生(endometrial glandular dysplasia, EmGD)可能是UPSC真正的前驱病变。
关键词:子宫乳头状浆液性癌;前驱病变;浆液性子宫内膜上皮内癌;子宫内膜腺体异型增生
1、子宫内膜癌的分型
根据生物学行为和临床特点,子宫内膜癌(endometrial carcinoma)可分为两型:雌激素相关型(I型)和非雌激素相关型(II型)。
I型癌发生于较年轻女性,表达ER和PR,通常在内膜增生的基础上发生,预后较好;II型癌发生于较年长的女性,不表达ER和PR,通常发生于萎缩的或静止的内膜,预后较差。组织学上,I型癌相当于内膜样癌,II型癌包括子宫乳头状浆液性癌和透明细胞癌等。分子遗传学上,两型癌显著的不同。I型癌常显示微卫星不稳定性、PTEN和K-ras突变,很少显示p53突变、p16表达缺失和her2/neu表达扩增;相反,II型癌显示高频的p53突变、常有p16表达缺失和her2/neu表达扩增。PTEN突变和MIN被认为是I型癌的早期事件,与癌的进展有关;而p53突变被认为是II型癌发生的早期事件,在II型癌假定的前驱病变中即已发生[1]。
2、UPSC及其假定的前驱病变
子宫乳头状浆液性癌(uterine papillary serous carcinoma, UPSC)最初由Lauchlan[2]于1981年描述,属于II型癌,在WHO新分类中称为浆液性腺癌(serous adenocarcinoma)[3]。由于难以早期发现,诊断时往往已有子宫外扩散,预后较差。临床医生和研究人员一直致力于探讨其前驱病变(precursor lesions),以便通过早期发现来改善治疗。
在WHO新分类[3]及相关文献[4,5]中,浆液性子宫内膜上皮内癌(serous endometrial intraepithelial carcinoma, SEIC)被称为UPSC的“一种假定的前驱病变(a putative precursor)”,并被定义为“形态学上等同于浸润性UPSC的高度恶性肿瘤细胞取代良性的(最常见为萎缩的)子宫内膜表面上皮或腺体,并且没有肌层或间质侵犯”[3]。不同研究者又分别称为子宫内膜原位癌(endomatrial carcinoma in situ)[6]、子宫表层浆液性癌(uterine surface serous carcinoma)[7]、子宫内膜上皮内癌(endometrial intraepithelial carcinoma)[8]和微小子宫浆液性癌(minimal uterine serous carcinoma)[9]等。
越来越多的研究表明,SEIC还不是真正意义上的前驱病变,因为这种假定的前驱病变的生物学行为不同于其他部位的上皮内癌或原位癌。其临床特征与浸润性UPSC相似,形态学上虽然没有肌层侵犯,但往往伴有子宫外扩散(通常累犯腹膜腔)[3]。SEIC发生子宫外病变和复发的机会均很高,具有完全恶性的生物学行为[5-7,9]。Spiegel[6]回顾了518例因子宫内膜癌切除的子宫标本,其中86例子宫内病变属于SEIC,发现这些局限于子宫内膜表面上皮或单个腺体内的微小病变,具有浸润性的恶性特征。Zheng等[7]研究6例SEIC,发现SEIC已存在p53过表达,呈UPSC的早期改变,并在前瞻性研究中发现其中1例已有间质和血管侵犯,因此认为SEIC虽然在形态学上表现为原位癌,但有转移潜能,应视为早期癌。Hui等[10]研究了40例完整手术分期的微小子宫浆液性癌,发现18例(45%)有子宫外肿瘤,随访1.5~62月其中8例死于复发。Soslow等[10]报道了3例SEIC同时发现腹腔浆液性癌,术后发现输卵管、卵巢门、卵巢表面和腹膜累犯。McCluggage等[12]报道5例SEIC中1例有卵巢血管内癌灶。Wheeler等[9]发现21例无肌层侵犯的SEIC中7例有子宫外病变。Silva等[13]报道了16例息肉中的非浸润性UPSC,10例表现为临床1A期,其中6例发生腹腔内复发,4例死于该病。Carcangiu等[14]报道了13例1A期SEIC,2例在清扫术后10和14月后死于腹腔内肿瘤复发。Slomovitz等[15]复习32例1A期无子宫侵犯的SEIC,手术分期13例(40%)已是III期或IV期。
最近Zheng等[16]回顾9例SEIC(<1cm)和8例1A期UPSC(≥1cm,无肌层浸润),所有病例均有包括网膜切除在内的手术分期。发现9例SEIC中6例(67%)具有子宫外病变,其中3例浆液性癌累及卵巢和网膜,1例累及输卵管,1例累及宫颈内粘膜,1例腹腔冲洗液阳性。在8例1A期UPSC中5例(63%)具有子宫外病变,其中1例轻微累及卵巢,3例广泛累及卵巢和网膜,1例仅累及网膜。就子宫外受累而言,SEIC(<1cm)和非浸润性UPSC无统计学差异。Zheng等[16]根据自己和他人的研究提出,SEIC不是真正的上皮内癌,与其他部位的原位癌不同,在没有肌层浸润的情况下可以向外扩散;活检诊断为SEIC者经完整的手术分期后级别增高[15]。SEIC应被看作是UPSC的早期病变(早期癌)[7,16],其临床处理与公认的原位癌不同(见下文)。
3、新近提出的UPSC的前驱病变
由于UPSC发生在萎缩或静止的子宫内膜,形态学无可争议地显恶性特征[9,17-19],所以在完全良性和完全恶性的腺体之间,理应存在某种形式的过渡来充当UPSC的前驱病变的角色。Zheng等在其研究的基础上,新近描述了一种病变,称为子宫内膜腺体异型增生(endometrial glandular dysplasia, EmGD),作为静止的良性腺体和SEIC之间的过渡类型[19]。EmGD可能是UPSC发生过程中最早的形态学上可识别的上皮内病变,可能是真正意义上的癌前病变。
将EmGD看作是SEIC和UPSC的前驱病变是基于下列原因。首先,EmGD和SEIC之间以及SEIC和UPSC之间常常有形态学过渡,而EmGD和UPSC之间没有直接过渡。第二,在UPSC病例,EmGD常为多灶状,累及与肿瘤主体不相连的区域;相反,EmGD与SEIC常有密切的联系。第三,EmGD的细胞学非典型性尚达不到SEIC。第四,EmGD常显示多个染色体部位,尤其是17q(TP53)和1p杂合性缺失。此外,在分子学对应研究中,EmGD与SEIC或UPSC具有一致的杂合性缺失[20]。
Zheng等提出的UPSC的发生模型是“静止内膜—EmGD—SEIC—UPSC”[19]。根据这个模型,p53肿瘤抑制基因的改变是一个早期事件,累及EmGD、SEIC和UPSC[7,15,19-21]。p53免疫组化染色和p53突变分析有助于UPSC的早期发现。SEIC常伴有子宫外病变,所以还算不上前驱病变。EmGD与子宫外病变的关系,EmGD发展成SEIC或UPSC的速度,以及其它分子学改变的研究正在进行中。
4、EmGD的诊断标准
1) EmGD的细胞学异型性程度尚达不到SEIC,但比伴或不伴化生性改变的良性静止期腺体的异型性大[19]。
2)EmGD显示p53免疫染色阳性。按照以前[7]描述的p53评分方法,EmGD评分应在4-6分以上。p53免疫染色有助于区分反应性和/化生性改变,后二者评分一般低于4。
3)光镜下,EmGD细胞核呈圆形或卵圆形,比良性静止期内膜的核增大2~3倍。核染色质深染或空泡状。核染色质深染时,其程度低于SEIC所见的明显恶性。核仁可疑,不显著。部分细胞极性紊乱。可见核分裂像和凋亡小体,但较难确定。
4)EmGD可出现于内膜表面上皮或内膜腺体,可表现为内膜息肉或非息肉样内膜。最常发生于静止期内膜,包括萎缩内膜、无反应性或弱增殖性内膜;增生期样内膜也不少见;但极少伴内膜增生[19]。
5、EmGD、SEIC及EIN的区别
SEIC由明确无疑的恶性浆液性细胞组成,形态上与UPSC的癌细胞完全相同,被认为是UPSC的一种早期形式。EmGD的细胞核异型性程度比SEIC低,但比伴或不伴化生性改变的良性静止期内膜上皮的异型性高。EmGD被认为是SEIC和UPSC的一种假定的前驱病变。EIN(endometrial intraepithelial neoplasia,子宫内膜上皮内瘤变)和/或子宫内膜不典型增生(atypical endometrial hyperplasia)是I型癌的前驱病变形式[22]。EIN主要发生于围绝经期妇女,而EmGD主要发生于绝经期后(平均年龄比I型癌晚10年)。
6、EmGD及SEIC的临床处理
EmGD的临床处理相关资料有限。根据Zheng等[16]的经验,若活检标本明确诊断为EmGD,并具有高度危险因素(如乳腺癌和/或卵巢癌病史),且患者手术耐受性好,可切除子宫,病理检查全部子宫内膜(间隔3-5mm)。若内膜活检或诊刮标本“考虑EmGD但不能确诊”,则作连续阴道内超声检查,观察内膜形状和厚度;若内膜增厚,则活检。目前还不知道EmGD的临床相关性。有关它与SEIC及UPSC的关系需要前瞻性研究,才能进一步明确EmGD是否就是UPSC真正的前驱病变。针对EmGD的最佳处理方法有待于进一步研究。
SEIC的生物学行为难以预测,部分SEIC病例具有侵袭性,临床上如何适当处理尚无一致意见。大多数研究认为,完整的手术分期对预后极其重要;经过仔细分期若没有子宫外病变(I/II期)则预后好,相反,即使子宫外病变很小预后亦差[7,9,16,23-25]。SEIC完整的手术分期[16]包括子宫及双附件切除、盆腔和主动脉旁淋巴结清扫、网膜切除术、腹膜活检和盆腔冲洗。对所有子宫切除发现残留病变的患者,无论SEIC或UPSC是局限在子宫内膜还是伴有子宫外病变都要进行放化疗;对子宫切除没有残留病变并且没有子宫外浆液性癌的患者,不采用进一步的治疗。
参考文献
1. Lax SF. Dualistic model of molecular pathogenesis in endometrial carcinoma. Zentralblatt fur Gynakologie 2002;124(1):10-6
2. Lauchlan SC. Tubal (serous) carcinoma of the endometrium. Arch Pathol Lab Med 1981;105:615– 8.
3. Tavvassoli FA, Devilee P. World Health Organization classification of tumours, pathology and genetics of tumours of the breast and female genital organs. Lyon: IARC Press, 2003. 225.
4. Ambros RA, Sherman ME, Zahn CM, Bitterman P, Kurman RJ. Endometrial intraepithelial carcinoma: a distinctive lesion specifically associated with tumors displaying serous differentiation. Hum Pathol 1995;26:1260– 7.
5. Gehrig PA, Groben PA, Fowler WC Jr, et al. Noninvasive papillary serous carcinoma of the endometrium. Obstet Gynecol 1997;153-57
6. Spiegel GW. Endometrial carcinoma in situ in postmenopausal women. Am J Surg Pathol 1995;19:417–32.
7. Zheng W, Khurana R, Farahmand S, et al. p53 immunostaining as a significant diagnostic marker for uterine surface carcinoma-precursor lesion of uterine papillary serous carcinoma. Am J Surg Pathol 1998;22:1463-73
8. Sherman ME, Bitterman P, Rosenshein NB, Delgado G, Kurman RJ. Uterine serous carcinoma: a morphologically diverse neoplasm with unifying clinicopathologic features. Am J Surg Pathol 1992;16: 600– 10.
9. Wheeler DT, Bell KA, Kurman RJ, Sherman ME. Minimal uterine serous carcinoma: diagnosis and clinicopathologic correlation. Am J Surg Pathol 2000;24(6):797– 806.
10. Hui P, Kelly M, O'Malley DM, et al. Minimal uterine serous carcinoma: a clinicopathological study of 40 cases. Mod Pathol. 2005;18(1):75-82.
11. Soslow RA, Pirog E, Isacson C. Endometrial intraepithelial carcinoma with associated peritoneal carcinomatosis. Am J Surg Pathol 2000;24(5):726– 32.
12. McCluggage WG, Sumathi VP, McManus DT. Uterine serous carcinoma and endometrial intraepithelial carcinoma arising in endometrial polyps: report of 5 cases, including 2 associated with tamoxifen therapy. Hum Pathol. 2003;34(9):939-43
13. Silva EG, Jenkins R. Serous carcinoma in endometrial polyps. Mod Pathol 1990;3:120 –8.
14. Carcangiu ML, Chambers JT. Uterine papillary serous carcinoma: a study on 108 cases with emphasis on the prognostic significance of associated endometrioid carcinoma, absence of invasion, and concomitant ovarian carcinoma. Gynecol Oncol 1992;47:298–305.
15. Slomovitz BM, Burke TW, Eifel P, Ramondetta LM, Silva EG, Jhingran A, et al. Uterine papillary serous carcinoma (UPSC): a single institution review of 129 cases [see comment]. Gynecol Oncol 2003;91:463–9.
16. Zheng W., Schwartz PE. Serous EIC as an early form of uterine papillary serous carcinoma: recent progress in understanding its pathogenesis and current opinions regarding pathologic and clinical management. Gynecol oncol 2005;96:579-82
17. Sherman M, Bur ME, Kurman RJ. p53 in endometrial cancers and its putative precursors: evidence for diverse pathways of tumorigenesis. Hum Pathol 1995;26:1268– 74.
18. Zheng W, Liang SX, Yu H, et al. Endometrial glandular dysplasia: a newly defined precursor lesion of uterine papillary serous carcinoma. Part I: morphologic features. Int J Surg Pathol. 2004;12(3):207-23
19. Liang SX, Cheng L, Chambers SK, et al. Endometrial glandular dysplasia: a putative precursor lesion of uterine papillary serous carcinoma. Part II: molecular features. Int J Surg Pathol. 2004;12(4):319-31.
20. Tashiro H, Isacson C, Levine R, Kurman RJ, Cho KR, Hedrick L. p53 gene mutations are common in uterine serous carcinoma and occur early in their pathogenesis. Am J Pathol 1997;150: 177– 85.
21. Sherman ME. Theories of endometrial carcinogenesis: a multidisciplinary approach. Mod Pathol 2000;13:295-308
22. Muter GL. Diagnosis of premalignant endometrial disease. J Clin Pathol 2002; 55:326-31
23. Soslow RA, Shen PUF, Isacson C, Chung MH. The CD44v6-negative phenotype in high-grade uterine carcinomas correlates with serous histologic subtype. Mod Pathol 1998;11:194– 9.
24. Carcangiu ML, Tan LK, Chambers JT. Stage IA uterine serous carcinoma: a study of 13 cases. Am J Surg Pathol 1997;21:1507– 14.
25. Carcangiu ML, Chambers JT. Early pathologic stage clear cell carcinoma and uterine papillary serous carcinoma of the endometrium: comparison of clinicopathologic features and survival. Intl J Gynecol Pathol 1995;14:30-38.

华夏病理/粉蓝医疗
为基层医院病理科提供全面解决方案,
努力让人人享有便捷准确可靠的病理诊断服务。



















 提议斑竹将此贴设为精华贴!
提议斑竹将此贴设为精华贴!














