| 图片: | |
|---|---|
| 名称: | |
| 描述: | |
- 对冰冻切片的几个疑问?
我们经常说冰冻切片组织不能用水冲,否则会引起冰晶。包埋剂如胶水,含有水份,所以也会引起冰晶,这样的理论对不对?
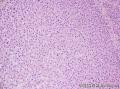
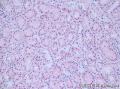
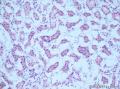
我今天特意买了一个猪肾、一块猪肝,取材取好后,分别用立即冷冻、取好后浸在水里十分钟后拿出再冷冻二种方法,然后分别采用OCT包埋和胶水包埋,结果显微镜下用肉眼看不出什么区别。
而且用胶水切的片要比OCT的平整,因为OCT的质地比较韧,容易出现切片上有横纹;OCT的收缩度往往比组织的大,切片上组织的面积往往大于OCT的外圈,因此在粘片时经常会有皱折。而胶水包埋的切片就非常平整。
所以,就这些问题我希望大家能够回去做一下,讨论一下,看看问题的真实现象是什么。
上图是用胶水做包埋剂切的片子:
-
本帖最后由 dingwei 于 2012-07-05 13:49:18 编辑

- 本人观点纯属个人偏见,希望大家独立判断,正确引用!中华病理技术网:http://www.zhbljs.com/
-
蝴蝶兰dali2003 离线
- 帖子:11421
- 粉蓝豆:2441
- 经验:11985
- 注册时间:2009-09-06
- 加关注 | 发消息
我个人觉得组织本身都带有一定的水分,岂不是本身冰冻后就都会有冰晶产生?我觉得不是。当水分大量浸透组织后。使组织明显肿胀、水肿,这时候冰冻后的组织才会有冰晶产生。有时候,我们冰剩后的组织固定了半个小时以内还拿来做冰冻,冰晶的现象都不是很明显(当然,其中我们会做一些小处理)。个人觉得:胶水和OCT最明显的一点区别可能是细胞大小的差别,胶水包埋染出来的细胞形状感觉要小点,不过胶水包埋的组织更好切,胶水本身又很经济适用,所以我们一直用胶水。
如果是这样,可能你做的都有冰晶,只是你不认识,一直认为正常应该就是这样。

- 本人观点纯属个人偏见,希望大家独立判断,正确引用!中华病理技术网:http://www.zhbljs.com/
我们一直都是用OCT,明天就去买一瓶胶水来试一下。另外,有时标本己经放在固定液里了,但是临床要求做冰冻(这种情况多见于手术室来了新手,不知道冰冻切片标本无须固定的那个时段),我们就先把标本捞出来,用干纱布吸水后再取材,片子切出来感觉冰晶也不太多。遇到这种标本,众网友是如何处理的?
用纱布吸干水份,可以加快冷冻速度,是一个非常好的办法。

- 本人观点纯属个人偏见,希望大家独立判断,正确引用!中华病理技术网:http://www.zhbljs.com/
-
angyang303 离线
- 帖子:79
- 粉蓝豆:15
- 经验:105
- 注册时间:2009-05-21
- 加关注 | 发消息
冰晶的形成主要是温度停留在零下12-16度的时间太长,故无论用什么方法,用何种包埋剂,只需要跳过这个温度差,产生的冰晶就少。
因为水的热容大,为4.2*10 3 ,相对于细胞外骨架、内骨架 及细胞膜而已大的多,故先用吸水纸吸水的目的是让组织更快的达到-16以下。
对于泡在水中太久,细胞因环境离子浓度差,导致细胞内水分多,故相对冷却时间增加,停留在冰晶形成区域温度的时间就长,故更容易形成冰晶。这也是为什么含水多的组织难做冰冻的原因。
另外冰晶形成还有一个不容易注意的细节:展片后没有及时的放入固定液中,尤其在热的南方更是如此,我已做相关对比试验。同组织同方法切片,1s 2s 3s 4s 5s 6s 7s 8s 15s 30s 1m 后放入固定液中,1-3s不会出现冰晶,5s之后可能出现, 时间越长含细胞内水越多的组织越明显(以上结论的论文将近期发表)。 同时 ,离子型固定液在同种情况下更容易形成冰晶,故 设计固定液成分时尽量避免离子产生,建议使用苦味酸-丙酮-甲醛 混合固定液。
-
angyang303 离线
- 帖子:79
- 粉蓝豆:15
- 经验:105
- 注册时间:2009-05-21
- 加关注 | 发消息