| 图片: | |
|---|---|
| 名称: | |
| 描述: | |
- B272右侧腹股沟肿块-多形性透明血管扩张性肿瘤( PHAT)
| 姓 名: | ××× | 性别: | 男 | 年龄: | 66 |
| 标本名称: | 右侧腹股沟肿块 | ||||
| 简要病史: | 发现右腹股沟包块20余年,手术所见:右腹股沟皮下可见一4X2X1CM包块,质硬,边界清。 | ||||
| 肉眼检查: | 组织一块4X3X3CM,肿块表面光滑,一侧附梭皮4X2.5CM,肿块位于皮下,切面周边灰白,中央呈斑彩状,质中。 | ||||
-
本帖最后由 于 2007-04-27 07:10:00 编辑
相关帖子
- • 右腹股沟肿块
- • 腹股沟肿块
- • 左腹股沟肿块
- • sbvingt腹股沟肿块
- • 腹股沟占位JPDIX
- • 男 67岁 左腹股沟肿块半月
- • 腹股沟肿块
- • 淀粉样瘤?
- • 左腹股沟淋巴结
- • 腹股沟肿物
-
benben520sps 离线
- 帖子:1045
- 粉蓝豆:568
- 经验:1254
- 注册时间:2009-07-28
- 加关注 | 发消息
临床与实验病理学杂志 J Clin Exp Pathol 2005 Oct; 21 (5)
软组织多形性透明变性血管扩张性肿瘤
张仁亚1韩庶勇2*许艳梅2
【关键词】软组织肿瘤;血管扩张;透明变性;多形性
【中图分类号】R73816 【文献标识码】A 【文章编号】100127399 (2004)
软组织多形性透明变性血管扩张性肿瘤(pleomorphic hyalinizing angiectatic tumor of soft parts,PHAT)是一种新近认识的软组织肿瘤类型[1~5],此肿瘤由Smith等[1]于1996年首先报道。肿瘤界限较清楚,镜下显示三个特征性的形态学改变:簇状分布扩张性的薄壁血管;分布于扩张血管之间的多形性瘤细胞;血管壁、血管周围及瘤细胞之间伴有明显的透明变性。该肿瘤是一种罕见的低度恶性肿瘤[1,6~8],截至目前为止英文文献已有65例报道[1~11],但多数为个案或短篇报道,国内仅见3例报道[12,13],范钦和[14]以中间型血管肿瘤对PHAT做了介绍。2002年WHO《软组织肿瘤和骨肿瘤的病理学和遗传学》分类[15]中将其列入不能确定分化的良性肿瘤。目前关于PHAT的最大的一项研究是Folpe等[8]最近报道的,并将PHAT分为早期PHAT和典型PHAT两个亚型,两者之间有广泛的组织学重叠,在同一病变内两种结构时常混合存在。由于该肿瘤高度的局部复发率(33%~50%),临床多采用局部扩大手术,但至目前为止尚无转移报道。为了进一步提高对该肿瘤的认识,详细研究其临床病理特征,扩大诊断和鉴别诊断的范围,更加有利于指导临床治疗及预后判断,我们结合自己实际工作中的病例并结合文献对该肿瘤作一综述。
1 临床表现
复习文献68例PHAT,主要发生在成人,年龄最小10岁[8],最大86岁[11],平均年龄54岁,男女均可发病(男28例,女40例)。
68例PHAT中,绝大多数(63例)位于皮下组织内,其中26例位于下肢,累及踝部(7例)/足部(16例),上肢3例,会阴3例,8例分别位于手部、臀部、胸壁、背部、腘窝、腋窝、腹股沟、颈部。3例发生于深部肌肉组织内。1例位于后腹膜[12],1例发生于颊黏膜[11]。临床上多数患者表现为局部缓慢生长的肿块,发生后腹膜内1例患者右下腹疼痛半年。病程从2个月至38年不等。临床诊断多为良性肿瘤。本例患者女,30岁。发现右腹股沟肿物半年余。肿物位于右腹股沟皮下,如鸡蛋大小,边界清,可活动,与周围无粘连,完整切除,临床诊断:皮肤纤维瘤。
2 病理特征
2.1 眼观 肿块圆形或卵圆形,部分呈分叶状,边缘多呈浸润性生长,将周围正常组织裹入肿瘤组织之中,少数病例肿瘤周围境界清楚,有纤维性假包膜。瘤组织多彩状,褐色到棕褐色,部分呈灰白色,常有灶性出血或囊性变。本例肿物呈卵圆形,6cm×5cm×5cm,包膜完整菲薄,切面大部分为实性,灰白色,质略硬,小部分为大小不等的囊腔和裂隙,内含少量灰红色液体。
2.2 组织学改变及类型
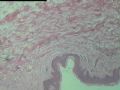
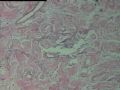
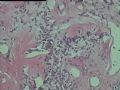
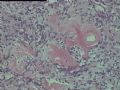
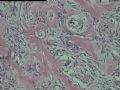
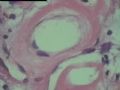
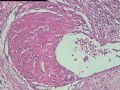
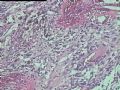
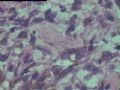
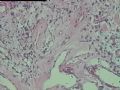
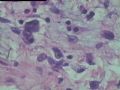
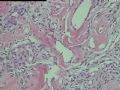
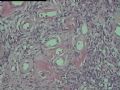
2.2.1 PHAT典型的组织学改变 肿瘤境界清楚,具有3个特征性的形态学改变:(1)成簇分布扩张性的薄壁血管(图1),血管大小不等,散在性分布于肿瘤内,扩张的血管内衬梭形内皮细胞,有或无红细胞,有时血管腔内可见有血栓;(2)呈片状或条索状分布于扩张性血管之间的梭形和圆形瘤细胞,胞质丰富,核多形性,深染,核内可见胞质假包含体,似恶性纤维组织细胞瘤,但核分裂象罕见,核分裂象不超过3个/50HPF[9]。(3) 血管壁、血管周围及瘤细胞之间基质明显透明样变性,围绕管壁形成“袖套”,并同时向周围肿瘤组织延伸,其本质为无定型嗜酸性物质,PAS、Masson三色、PTAH染色显示由胶原纤维组成。本例肿瘤主要由薄壁血管及纤维组织构成(图1),管腔大小不等,管壁及其周围的胶原纤维透明变性(图2),扩张的血管内衬梭形内皮细胞,腔内有少量红细胞,部分管腔内可见血栓。血管之间有多形性瘤细胞(图3),核深染,核仁清楚,部分瘤细胞显示明显的异型性,并可见瘤巨细胞。
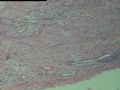
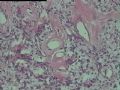
2.2.2 早期PHAT的组织学改变 在以前的文献报道中[1,3,8~10],很少有细胞稀少的黏液区域被描述,至少70%的PHAT从肿瘤外周至主要部分含有如此区域,因为很多肿瘤切除的边缘缺少足够的周围组织以及病理检查不彻底,所以很可能低估了细胞稀少的黏液区域存在的价值。其实在Smith等[1]报道的病例1中(原插图8),扩张的血管组成了肿瘤的很少部分,多数相似于含有丰富黏液基质的纤维肉瘤。Brim等[10]报道了1例发生于足部的PHAT,观察到典型的PHAT和细胞稀少的黏液特征,同样地,Fukunaga等[3]也注意到偶然出现的黏液变性和透明变性的细胞稀少区,Groisman等[9]也注意到了间质黏液变的细胞稀少区,王坚等[12]也观察到部分区域间质呈疏松水肿样,这种罕见改变的出现合理地解释为仅仅切除了典型的PHAT的主要病变部分,然而Folpe等[8]通过41例会诊资料的观察分析认为是PHAT前驱病变(即所谓的“早期PHAT”)。我们这例即可观察到黏液变的细胞稀疏区(图4)。看到其它早期病变还有:温和的梭形细胞含有大量的含铁血黄素,血管壁之间的多形性瘤细胞聚集,核内假包涵体以及肿瘤周围小的损害的血管和异常血管堆积。有些研究者认为这些改变是病变的早期和主要病变,而非单一肿瘤后期退行性的继发性的改变,尽管含铁血黄素可以用铁染色显示,核内假包涵体和小的扩张血管却很难证实,或许早期PHAT是PHAT前驱病变的最直接证据来自PHAT发生的早期观察者,事实上他们已经获得了典型PHAT的组织学表现,遗憾的是这种观察方法没有提出早期PHAT是如何发展成典型PHAT的。
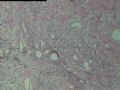
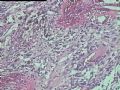
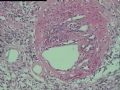
2.2.3 PHAT其它的组织学改变 除了上述典型和早期PHAT组织学改变外,PHAT还可以出现其它的组织学形态,当以这些变化的组织学形态为主是常被误诊为其它病变,这些形态包括(1)梭形细胞增生浸润至周围脂肪,尽管PHAT完全表现了典型的PHAT特征,但是其它病例却显示梭形细胞增生浸润至周围脂肪中(图5),梭形细胞温和,与典型PHAT中通常看到的一样,这些改变有时位于肿瘤中心,周围有小的扩张的血管。(2)血管壁上有较多再通微小管道:Groisman等[9]注意到在大量增生的非透明变性的血管内有大量的毛细血管渗入,这些表现促使他们探讨PHAT血管源性学说。(3)肿瘤间质淋巴细胞浸润灶及肥大细胞浸润灶,肿瘤间质有同心圆或层状钙化[9]。(4)肿瘤局灶性点状坏死。
2.3 免疫表型及流式细胞术
肿瘤细胞Vim弥漫强阳性[2,4,5,9,12],CD34约一半的病例阳性[1~4,7,9,12],CD99[4,9]、 FXIIIa[2,9]阳性,VEGF阳性[9],S-100蛋白阴性[1,5,9,12],上皮和非上皮标记阴性, Ki-67(MIB)约0.2%~3.5%肿瘤细胞阳性,增生活性较低[2,5,9]。流式细胞术表现为S相低分值表达[3],缺少非整倍体DNA,7%出现S相双倍体DNA[9]。本例免疫组化:CD34阳性,Vimentin、Des、EMA、CD117、Syn、CD68、CD31、S-100均阴性。
2.4 电镜观察
肿瘤细胞有多形性的核和胞质,胞质内见中间丝[1,5],免疫电镜证实其为波形纤维蛋白细丝,但内无神经内分泌颗粒[5],间质含有丰富的胶原束和局灶性的长间距的胶原,这些发现提示本瘤的间叶性特征,尚不能显示进一步的分化。
3 鉴别诊断
鉴别诊断应包括一些良性、交界性及恶性病变。即使早期PHAT有些微妙的特征出现,很多病例有可能被误认为各种良性或反应性的病变,像梭性细胞脂肪瘤,良性纤维组织细胞瘤或者结节性筋膜炎等。(1)梭形细胞脂肪瘤:缺少细胞质内的含铁血黄素和被损害的血管,具有明显的绳状胶原。(2)良性纤维组织细胞瘤:含有大量的含铁血黄素吞噬体,但梭形细胞缺少含铁血黄素,通常具有多核巨细胞、泡沫状巨细胞。(3)结节性筋膜炎:也缺少胞质内含铁血黄色,血管相对较少,间质增生的细胞特征性的“上窜下跳”,核分裂象可见,尤其是巨细胞型结节性筋膜炎更易和PHAT相混淆。(4)神经鞘瘤:当PHAT梭形细胞丰富而又出现细胞多形性时鉴别诊断要想到神经鞘瘤,S-100蛋白阴性对鉴别诊断有帮助,且肿瘤不具有神经鞘瘤的两种典型的组织学形态,即细胞型和疏松黏液样。(5)梭形细胞血管内皮瘤:发生在男性患者的肢体有多个小结节,而PHAT年龄偏大,且瘤细胞CD31等血管源性标记阴性,另一方面,梭形细胞血管内皮瘤的瘤细胞内可以发现衬附小管道或围绕充以血液的管腔的散在空泡状细胞,在PHAT看不到,前者呈良性形态表现,多形性不明显,有作者[16]已经提出是非肿瘤性的。(6)恶性纤维组织细胞瘤(MFH):尽管PHAT的瘤细胞呈多形性,甚至可出现核异型性的瘤巨细胞,与MFH相似,但核分裂象及肿瘤性坏死罕见,肿瘤细胞的核增殖指数不高,这些有助于与MFH鉴别。在鉴别诊断时要想到的肿瘤还有,孤立性纤维性肿瘤、巨细胞血管纤维瘤和黏液炎性肌纤维母细胞肉瘤[5]等。此外,PHAT瘤细胞多不表达EMA、SMA、MSA和desmin,这些免疫组化标记对炎性肌纤维母细胞瘤及软组织肌上皮瘤的鉴别诊断有帮助[12]。
4 组织起源
PHAT的组织起源目前尚不清楚,但是文献中提出了一些不同的假设[1,9]。Groisman等认为在PHAT的形成过程中血管的形成发挥着重要的作用。首先,通过组织学观察,大量的新生血管主要在肿瘤的周围区域。其次,除了透明变性的簇状血管外,肿瘤细胞、内皮细胞以及局灶性坏死区域VEGF强阳性表达,并做了详细分析认为,在肿瘤的形成过程中,VEGF直接地和选择性地刺激内皮细胞有丝分裂,在肿瘤组织和周围坏死区由于组织缺氧诱导VEGF的表达。
事实上,透明变性的血管是PHAT最典型的组织学特征,Smith等提出了两种可能的机制解释其形成,首先,肿瘤浸润造成的组织损伤导致肥大细胞产生血管活性物质释放,增加了血管的通透性。其次,肿瘤的不断生长侵蚀正常血管引起内皮的损伤和血浆成分渗出,血管周围透明物质的沉积,导致透明变性血管的形成。无论透明变性的簇状血管来源如何,它表明:透明变性物质的不断沉积导致血管内血栓形成和阻塞,继发肿瘤局部缺氧和坏死。Groisman等认为组织缺氧促使肿瘤细胞产生VEGF,从而引起活跃的新生血管产生,尤其是在肿瘤周边更为显著,随着肿瘤的进一步发展,先前存在的肿瘤造成的血管侵蚀导致新的透明变性簇状血管形成,最终血管消失,肿瘤性的缺氧进一步产生VEGF。
Groisman等的免疫组化研究结果排除了内皮、神经、组织细胞和肌源性的来源。根据文献研究[1~5,7,9,12]肿瘤细胞表现为Vimentin和CD34弥漫阳性,FXIIIa和CD99局灶性阳性。尽管PHAT Vimentin和CD34阳性,但这些肿瘤细胞的准确来源尚未阐明,不同肿瘤有不同的表达,在不同来源的软组织肿瘤中CD99缺少特异性,表达FXIIIa阳性的PHAT病例 Silverman等[2]已报道,并认为PHAT是由微血管CD34阳性的树突状细胞和间质FXIIIa阳性的指突状细胞组成的纤维组织细胞肿瘤,然而,正象他们阐述的那样,FXIIIa阳性是否是真正的肿瘤细胞抑或仅仅是肥大细胞的陪衬目前还不清楚。虽然肿瘤细胞的准确来源尚未明了,通过研究Groisman等[9]认为这些肿瘤细胞是未分化的原始间叶细胞,可能与间质内纤维母细胞有关。Matsumoto等[5]通过电镜发现肿瘤细胞胞质内有中间丝,提示该肿瘤起源于间质纤维母细胞,像孤立性纤维性肿瘤或者巨细胞血管纤维瘤一样,Fukunaga等[3]认为三者属同一肿瘤家族。
5预后与治疗
文献中报道的病例大多无明显包膜或界限,呈浸润性生长。Smith等[1]报道的14例患者中,随访8例,其中4例局部复发,1例呈明显的侵袭性生长而做了截肢手术,另1例多次复发。Folpe等[8]报道的41例中,有完整随访资料的18例(随访时间平均84个月,从13个月~420个月,中位52个月),其中6例(33%)复发,手术切除肿瘤后,16例无瘤生长,2例带瘤生长。
PHAT是一种具有显著临床病理特征的潜在或低度恶性软组织肿瘤,具有局部高复发率,有时具有侵袭性,但目前尚无转移的病例。无论PHAT起源如何,认识该类型肿瘤的临床重要意义,主要是做为一个局部浸润性的肿瘤应该把它广泛地进行局部切除。
| 以下是引用月新 在2006-11-10 20:57:00的发言:
我是第一次见该病例(多形性玻璃样变的血管扩张性肿瘤),感觉非常好,故翻译马老师的帖子如下:有不对之处请指出。
本例软组织肿瘤因其特殊的发病部位、肿瘤大小及组织病理学改变,应该是典型的软组织多形性玻璃样变的血管扩张性肿瘤(PHAT)。PHAT 较为罕见,组织来源不明(可能与神经鞘瘤或雪旺氏瘤有关)。被人认为是低度恶性,切除后有潜在局部复发可能性,但是未见有远处转移。镜下特殊的改变是部分中等大小的血管扩张、内含血栓,小血管玻璃样变性以及可见梭形细胞、星芒状细胞,偶见巨细胞,并可见部分胞浆内含铁血黄素。虽然肿瘤外周常有界线,可有菲薄之外膜,我个人意见该瘤多数情况下没有包膜,可以浸及包膜外,最近有人报告所谓的早期PHAT,早期的PHAT细胞数更多,粘液样变更明显,多形性则不明显。
|
国外期刊文摘
多形性透明血管扩张性肿瘤( PHAT) :41 例分析支持来自一个特有前驱病变的演化(英)
Folpe AL ,Weiss SW
ΠPleomorphic hyalinzing angiectatic tumor :analysis of 41 cases supporting evolution
fromadistinctiveprecursorlesion. AmJSurgPathol,2004,28 (11):1417-1425.
PHAT是一种罕见的低度恶性肿瘤,特征性的表现为伴有含铁血黄素沉着的间质细胞不典型增生,部分有血栓形成的扩张血管壁周围透明变性及数量不等的炎细胞浸润。多年来,作者偶尔观察到部分黏液样梭形细胞单一成分(暂称为早期PHAT) 合并经典的PHAT。在某些病例中,这种单一病变独立出现,提示是PHAT 演变的早期阶段。为了进一步证实这种设想,更好地阐述PHAT 的长期生物学行为,作者复习了所遇到的这些病变。41 例均为已确诊的会诊病例。
该肿瘤主要见于成人(10~79 岁,中位年龄51 岁),男女均可发病(女性23 例,男性18 例),肿瘤大小013~1917 cm(中位516 cm) ,位于踝/ 足(15 例) 、腿(10 例) 、股(6 例) 及其他部位皮下组织,其中13 例于活检前1 年发现肿瘤。15 例完全是经典的PHAT,12 例缺少经典的PHAT 特征,符合早期PHAT, 表现为短束状含铁血黄素沉积的梭形细胞,浸润至脂肪及周围有损害的小血管。所有病例在病变周围均偶尔发现经典的PHAT中可见到具有核内假包涵体的多形性细胞。14 例既含有经典的PHAT也有早期PHAT,比例不等。随访18 例(13~420 个月,平均84 个月) ,6 例复发,其中经典的PHAT 和伴早期PHAT各1 例,早期PHAT4 例。16 例手术切除后无瘤生存,2 例带瘤生存,无转移病例。基于早期和经典PHAT 有组织学重叠,早期PHAT 出现在经典的PHAT 的外周,以及两种结构混合存在于同一肿瘤内等特点,作者推测,早期PHAT代表了PHAT的前驱阶段,其本质和“含铁血黄素性纤维组织细胞瘤样病变”相同,支持后者不是反应性的,而是肿瘤性病变的观点。作者认为PHAT 是一种中度恶性的间叶性肿瘤,具有局部高复发性,有时呈侵袭性生长。
(山东省济宁医学院附属医院病理科 张仁亚译; 解放军第306 医院病理科 张建中校)
-
本帖最后由 于 2006-11-13 20:50:00 编辑
-
The anatomic location, size and histopathology of this soft tissue tumor are classic for pleomorphic hyalinizing angiectatic tumor (PHAT) of soft parts. PHAT is a rare soft tissue neoplasm of unclear cellular origin (presumed to be related to neurilemmoma or schwannoma). It is considered to be a low grade malignancy - with potential for local recurrence after resection but not for distant metastasis. Characteristic histologic features include partially thrombosed and ectatic medium sized blood vessels, cirferentially hyalinized smaller blood vessels, spindled or stellate cells with occasional giant forms, and focal collection of cells containing cytoplasmic hemosiderin. Although thin encapsulation at its periphery has been reported, my personal limited experience with this tumor is that many are not encapsulated and can have infiltrative borders. This is especially true for the so-called "early" PHAT recently described. Early PHAT are more cellular, myxoid, and less pleomorphic.

聞道有先後,術業有專攻








 学习了,谢谢!
学习了,谢谢! 


















