| 图片: | |
|---|---|
| 名称: | |
| 描述: | |
- B6-2:北京军区总医院
B6-2:北京军区总医院
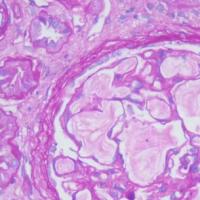
女,60岁。左乳肿物2月。2月前发现左乳肿物,有触痛,曾到多家医院就诊,诊为左乳腺增生病,未做治疗,肿物逐渐长大。查体:左乳外上象限扪及肿物,大小约3x3cm,边界不清,左腋窝查见直径约0.5cm淋巴结。手术中见肿物直径约3cm,质硬,边界不清。送冰冻检查,肉眼:灰白色肿物一块1.5x1.2x0.5cm,切面灰白色,实性,质韧。冰冻病理诊断为乳腺癌,行左乳改良根治术。术后化疗一疗程后前来会诊。

名称:图1
描述:图1

华夏病理/粉蓝医疗
为基层医院病理科提供全面解决方案,
努力让人人享有便捷准确可靠的病理诊断服务。
1:a.浸润性小叶癌;b.假淋巴瘤
2:浸润性癌伴大量淋巴细胞浸润(淋巴上皮癌)
3:浸润性小叶癌伴淋巴细胞反应
4:浸润性导管癌Ⅱ級
5:因切片光盘不能邮寄,故无结果
6:因切片光盘不能邮寄,故无结果
7:高级别浸润性癌,淋巴上皮癌。
8:浸润性小叶癌伴大量淋巴细胞浸润
9:考虑1、浸润性癌 2、淋巴造血系统肿瘤
10:? lymphoma - need further staining
11:左侧乳腺浸润性癌,首先考虑浸润性小叶性癌。
12:考虑淋巴上皮样癌。
13:硬化性淋巴细胞性乳腺炎
14:1.考虑浆细胞性乳腺炎;2.除外淋巴造血系统肿瘤
15:淋巴细胞性乳腺炎。
16:左乳:多考虑1.硬化性淋巴细胞性小叶炎,上皮变性,上皮内炎细胞浸润明显,炎细胞以淋巴细胞、浆细胞为主。2.淋巴上皮瘤样癌。3. 淋巴瘤(霍奇金淋巴瘤,间变大细胞淋巴瘤)
17:1.淋巴上皮瘤样癌;2.浸润性小叶癌;3.淋巴瘤(粘膜相关)
18:乳腺浸润性癌,类型考虑为多形性小叶癌。需鉴别:1、浸润性导管癌;2、慢性炎症。
19:考虑皮脂腺癌/淋巴
20:(左乳)恶性肿瘤,需免疫组化检查进一步确诊
江西省肿瘤医院:恶性肿瘤(1.癌;2.弥漫大B细胞淋巴瘤)
21:倾向浸润性导管癌,有癌巢,核仁明显
22:因切片光盘不能邮寄,故无结果
23:不典型导管上皮增生。
24:1、淋巴上皮瘤样癌;2、髓样癌; 3、淋巴造血系统疾病(淋巴瘤?)
25:(左乳)肉芽肿性小叶性乳腺炎。
26:左乳腺癌淋巴结转移
27:髓样癌、富于脂质癌、肌上皮癌、霍奇金淋巴瘤。
28:考虑:a.淋巴组织增生性病变,淋巴瘤或淋巴组织瘤样增生;b. 需结合病史排除透明细胞癌转移。
29:①浆细胞乳腺炎伴上皮增生及假浸润 ②淋巴上皮瘤样癌
30:考虑:1 转移性低分化癌(印戒细胞癌) 2 浸润性小叶癌 3 炎症待排除
31:Rosai-Dorfman
32:组织细胞样浸润性导管癌
33:浸润性小叶癌
34:乳腺低度恶性肿瘤,边缘带B细胞淋巴瘤。
鉴别诊断:浆细胞性乳腺炎。可行免疫组化鉴别,必要时可做基因重排。
35华夏病理网:炎性假瘤(Inflammatory pseudotumor)
出片单位:
A.HE:略
B.免疫组化结果: 肿瘤细胞上皮标志物CK、CK5/6、CK8/18和EMA均(+),34bE12和E-cadherin(+),P120胞膜与胞浆均(+),EGFR(+),ER(+ <5%),PR(+ >75%),Ki-67阳性指数30%,CK14、CK17、Mammaglobin、GCDFP-15、C-erbB-2、p53、p63、SMA、CD30及ALK均(-)。CD3、CD20肿瘤细胞(-)、背景淋巴细胞(+),以CD20(+)居多,在淋巴滤泡样结节中表现更为明显。病毒检测:EBV与HPV均(-)。
CK(AE1/AE3) 34bE12(+)
E-cadherin(+) P120(+),胞膜与胞浆双表达
C.意见: 淋巴上皮瘤样癌
讨论: 乳腺淋巴上皮瘤样癌是罕见的具有鲜明形态学特征的乳腺癌类型,但在WHO乳腺肿瘤分类(2003年版)并未提及。据文献报道,该肿瘤发生于中老年妇女(年龄分布42-69岁);其中发生于右侧乳腺11例,左侧5例;肿瘤直径1.0
1. 组织学特点 乳腺LEC的显著特点是有大量弥漫淋巴组织增生浸润,有时有淋巴滤泡样结节形成。在密集淋巴细胞背景中散在分布未分化上皮细胞,这些细胞体积大,胞浆丰富,泡状核,核仁明显,呈嗜酸性或双嗜性,亦可见双核或多核细胞(类似于H/RS细胞)。核分裂多少不等,通常没有坏死。一般认为,LEC有两种不同的组织形态,即:Regaud型与Schminke型。Regaud型表现为,呈片状、巢状或条索状排列的上皮细胞,分布在密集浸润的淋巴细胞中,肿瘤细胞团与淋巴细胞分界清楚;Schminke型中的上皮细胞则呈独立的小巢状或散在单个分布。这两种类型常同时存在。
文献报道的16例LEC中,3例有浸润性小叶癌,1例有小叶不典型增生;据此,有认为LEC可能是浸润性小叶癌的变异型。
2. 免疫表型特点 乳腺LEC的免疫表型与一般浸润性癌类似。上皮标记物阳性,而ER、PR、C-erbB-2、E-cadherin等染色结果报道不一;背景淋巴细胞CD20与CD3呈多克隆性表达;E-cadherin阳性,提示可能是导管癌,但同时34E12阳性表达,P120染色则显示胞膜与胞浆双表达,有研究认为该免疫表型提示E-cadherin并不具有功能,小叶癌也可出现;可见,LEC究竟是导管癌还是小叶癌,从免疫表型上讲,尚难有定论。此外,CK5/6、34E12和EGFR阳性,而ER、Her-2阴性,提示此例具有基底细胞样癌的某些特征。
3. 鉴别诊断 乳腺LEC的鉴别诊断包括髓样癌及不典型髓样癌、淋巴瘤(特别是霍奇金淋巴瘤)、富于淋巴细胞的浸润性导管癌及小叶癌,富于淋巴细胞的导管原位癌及小叶原位癌,硬化性淋巴细胞小叶炎等。(1)髓样癌及不典型髓样癌:虽然髓样癌及不典型髓样癌有大量淋巴细胞浸润,但诊断髓样癌有严格的标准:主要由合体型细胞(≥75%)构成、缺乏腺管结构、高级别核、核分裂多、间质内有明显淋巴细胞浸润、具有清楚的推挤性边缘;不典型髓样癌(有认为是富于淋巴细胞的浸润性导管癌)除有≥75%的合体型细胞外,还具有上述其他2项或3项组织学特征,但也可呈浸润性生长,细胞分化也可较好,核分裂可较少,亦可有明显的腺样或乳头状结构。LEC通常为浸润性边缘,合体型细胞少见,更缺乏成片排列的合体细胞。(2)淋巴瘤:在LEC中,恶性上皮细胞散在分布在弥漫浸润的淋巴细胞中,常难与霍奇金淋巴瘤鉴别。经典型结节硬化型霍奇金淋巴瘤,表现为由纤维条带分隔的结节状密集淋巴细胞,其中见H/RS细胞,RS细胞与LEC中的癌细胞很类似。区别两者有效的方法是多切片,仔细全面观察,如发现小叶不典型增生或原位癌,则支持癌的诊断。免疫组化对两者的鉴别很有意义,霍奇金淋巴瘤和大细胞间变性淋巴瘤CD30与CD15阳性,CK阴性,而LEC免疫表型恰恰相反。 (3) 富于淋巴细胞的浸润性导管癌及小叶癌:部分浸润性导管癌及小叶癌,间质内有多少不等淋巴细胞浸润,有时有大量淋巴细胞浸润,甚至伴淋巴滤泡形成,但通常不如LEC弥漫,且具有浸润性导管癌或小叶癌的典型结构(腺管状、筛状、片状、列兵状等)和细胞学(单一低级别核、胞质内空泡、明显的细胞界限等)特点,间质有更明显的硬化。LEC缺乏腺管和大片状或列兵状结构,呈单个、小簇、小巢片状分布,细胞大,胞浆丰富、淡染或嗜酸性,泡状核,核仁明显、呈嗜酸性或双嗜性。(4)富于淋巴细胞的导管原位癌及小叶原位癌:LEC可呈结节状外观,淋巴细胞区和淋巴滤泡样区内有癌细胞岛,类似导管原位癌或小叶原位癌;有时淋巴组织内亦有残留腺管和原位癌成分,易误诊为富于淋巴细胞的导管原位癌及小叶原位癌。诊断困难的病例,可进行免疫组化标记肌上皮(如P63、CD10、Calponin等),以资鉴别。(5)乳腺炎症:如硬化性淋巴细胞小叶炎,表现为以小叶为中心的小叶内、小叶周围大量淋巴细胞浸润,低倍镜下呈结节状,小叶内腺管上皮可增生,并可出现不典型性,增生细胞亦可被淋巴细胞打乱,少数LEC具有淋巴细胞小叶炎的背景,周围也有淋巴细胞小叶炎存在。两者鉴别一般并不困难,淋巴细胞小叶炎有小叶轮廓,周围有硬化带,淋巴浆细胞围绕在小血管周围,其中缺乏具有泡状核的恶性上皮细胞。
4. LEC与EBV、HPV的关系 据报道,发生在肺、胃、涎腺、胸腺与鼻咽等部位的LEC可检测出EBV。但是,用原位杂交或PCR等方法,在乳腺LEC中均未检测到EBV。探讨HPV与乳腺LEC的关系,仅有Kulka等1例报道。他们用原位杂交方法检测到,肿瘤细胞核HPV33型DNA阳性,免疫组化HPV16/18 E6染色检测到肿瘤细胞及周围终末导管-小叶单位胞浆阳性,P16染色肿瘤周围正常上皮细胞核阳性。但该病人15年前曾患宫颈原位癌,行子宫全切术,在宫颈病变检测出HPV33。因此,该例HPV阳性,是否与宫颈病变有关,尚难判断。本例未检测到EBV与HPV。
5. 预后 据文献描述,16例中13例随访7-72个月,未有死亡病例;4例有腋窝淋巴结转移,1例有胸骨旁淋巴结及肺转移。因此,一般认为乳腺LEC预后比较好。
参考文献:
1. 杨光之, 李静, 丁华野. 乳腺淋巴上皮瘤样癌3例临床病理分析. 诊断病理学杂志. 2009,16(4): 261-264
2. Kulka J, Kovalszky I, Svastics E, et al. Lymphoepithelioma-like carcinoma of the breast: not Epstein-Barr virus-, but human papilloma virus-positive. Hum Pathol, 2008, 39(2): 298-301.
3. Kurose A, Ichinohasama R, Kanno H, et al. Lymphoepithelioma-like carcinoma of the breast. Report of a case with the first electron microscopic study and review of the literature. Virchows Arch, 2005, 447(3): 653-659.

华夏病理/粉蓝医疗
为基层医院病理科提供全面解决方案,
努力让人人享有便捷准确可靠的病理诊断服务。
-
shihong4699 离线
- 帖子:1024
- 粉蓝豆:43
- 经验:2917
- 注册时间:2009-01-20
- 加关注 | 发消息
-
shihong4699 离线
- 帖子:1024
- 粉蓝豆:43
- 经验:2917
- 注册时间:2009-01-20
- 加关注 | 发消息
-
zhenshijian 离线
- 帖子:1069
- 粉蓝豆:91
- 经验:1364
- 注册时间:2008-04-20
- 加关注 | 发消息
-
本帖最后由 于 2011-04-22 22:57:00 编辑
我也有一个鉴别诊断,Rosen's Breast Pathology, 3rd Edition上的资料如下:
Inflammatory Pseudotumor
There is no well-characterized lesion of the breast that qualifies for this diagnosis. The diagnosis has been mistakenly applied to metaplastic carcinoma, granulomatous mastitis, fibromatosis, and infarcts. Localized nodular lesions in the breast consisting of interlacing bundles of myofibroblastic cells with a prominent infiltrate composed mainly of plasma cells and lymphocytes have been diagnosed as inflammatory pseudotumors (Fig. 3.21) (103,104,105,106). Chetty and Govender (105) described three histologic patterns: nodular fasciitis, interlacing fascicles of spindle cells in variably collagenized stroma, and a hypocellular variant composed mainly of hyalinized collagen resembling a scar. The three cases described in their report had varied appearances with differing proportions of these elements. Elevated serum immunoglobulin G4 (IgG4) level, which is associated with sclerosing pancreatitis has been reported in a patient with inflammatory pseudotumor of the breast (107). Immunohistochemistry revealed many IgG4-positive plasma cells in the lesional tissue. The patient did not have clinical evidence of pancreatitis.
Four reported patients had a unilateral lesion that did not recur after excision, but follow-up rarely exceeds one year (104,105). Another patient with bilateral tumors developed recurrences in both breasts (103).
The differential diagnosis includes other lesions rarely encountered in the breast such as Erdheim-Chester disease (14), previously discussed in the section on Fat Necrosis, and adult type “juvenile” xanthogranuloma (108). The latter lesion consists of a prominent spindle cell proliferation associated with multinucleated giant cells, including Touton type, lymphocytes, plasma cells, and xanthomatous histiocytes. The xanthomatous cells are reactive for KP1, MAC387, and PGM1, but negative for S100 and CD1a (108).
|
Fig. 3.21. Inflammatory pseudotumor. A: Peripheral fibrosis outlines the lesion. B: Lymphocytic infiltrates with germinal center formation in the midst of variably collagenized stroma. C: A few multinucleated histiocytes and scattered plasma cells are shown. D: Histiocytes are highlighted by the MAC immunostain (avidin-biotin). |
Reference
14. Barnes PJ, Foyle A, Hache KA, et al. Erdheim-Chester disease of the breast: A case report and review of the literature. Breast J 2005;11: 462–467.
103. Yip CH, Wong KT, Samuel D. Bilateral plasma cell granuloma (inflammatory pseudotumour) of the breast. Aust N Z J Surg 1997;67:300–303.
104. Pettinato G, Manivel JC, Insabato L, et al. Plasma cell granuloma (inflammatory pseudotumour) of the breast. Am J Clin Pathol 1988;90:627–632.
105. Chetty R, Govender D. Inflammatory pseudotumor of the breast. Pathology 1997;29:270–271.
106. Haj M, Weiss M, Loberant N, et al. Inflammatory pseudotumor of the breast: Case report and literature review. Breast J 2003;9:423–425.
107. Zen Y, Kasahara Y, Horita K, et al. Inflammatory pseudotumor of the breast in a patient with a high serum IgG4 level: Histologic similarity to sclerosing pancreatitis. Am J Surg Pathol 2005;29:275–278.
108. Shin SJ, Scamman W, Gopalan A, et al. Mammary presentation of adult-type “juvenile” xanthogranuloma. Am J Surg Pathol 2005;29:827–831.
109. Kim SM, Park JM, Moon WK. Dystrophic breast calcifications in patients with collagen diseases. J Clin Imaging 2004;28:6–9.

名称:图1
描述:图1

华夏病理/粉蓝医疗
为基层医院病理科提供全面解决方案,
努力让人人享有便捷准确可靠的病理诊断服务。