| 图片: | |
|---|---|
| 名称: | |
| 描述: | |
- 如何零基础开展多重荧光免疫检测业务?-系列1
-
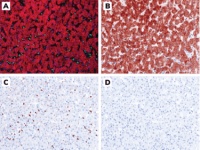
2023-03-13 泰立瑞病理 多重免疫荧光/免疫组织化学(mIF/IHC)是研究肿瘤空间微环境(TME)的较新工具,在癌症免疫治疗方面的临床和转化应用都具有很高的潜力——特别是在以TME本身作为生物标记物以更准确地预测患者对免疫治疗的反应以及在组织标本供应有限的情况下。系统性回顾和最新的研究分析表明,与传统的单项IHC分析相比,mIF/IHC改进了对10种实体瘤类型PD-1/PDL-1检查点阻断免疫治疗反应的预测⑴。我们以FAQ的形式介绍如何从0开展多重免疫组化业务? 1. 病理医生在开发一个mIF/IHC套餐中(panel)能其什么作用? 病理医生应参与mIF/IHC套餐开发过程中的每个步骤,从panel设计到最终质量控制(QC)。病理医生需要为组织样本的生物标记物选择、验证、试验方法、质量控制等问题提供科学和临床指导。病理医生也需要解释数据。任何mIF/IHC成功开发都取决于病理医生、项目技术人员和免疫科学家之间的成功合作,经常还需要免疫治疗药物厂家的支持。 2. 我们应该开展mIF/IHC业务吗? 主要的决定因素应该是你们业务发展的需要,尤其是你们医院的临床是否需要,要考虑这项业务的开展会给临床医生和患者带来那些收益。然后可能要考虑的是科学问题,开展这项业务可能会给医学科学研究带来那些新发现。另外,也要考虑样本可用性。由于mIF/IHC套餐设计和验证比传统的单IHC要求更高,因此只有在传统的单一IHC分析无法回答我们的科学研究和解决临床问题时才应使用mIF/IHC套餐。例如,如果所需数据仅限于整个切片或区域层面上多个抗体标记的丰度,并且使用多个切片的单一IHC就够用了。然而,如果所需数据要求包括同一细胞的多个标记物的共定位、不同表型的单个细胞之间的邻近距离测量及其相对空间分布,mIF/IHC的信息量更大。最后,如果样品珍贵或难以获取,也有必要转向开发mIF/IHC解决方案。 3. 我们实验室已经在平时的常规IHC诊断工作验证了许多传统的单一IHC方法。我们能利用已经验证的多个单一IHC检测方法学来快速开发一个的mIF/IHC套餐吗? 有多种方法可以利用已开发的单一 IHC来指导多重免疫组化mIF/IHC的开发。 最简单的方法是开发一种传统单IHC的循环染色方法,就是依次进行抗体染色-全玻片扫描-抗体剥离/去除的循环,然后融合和对齐每个循环采集的全切片图像。但这种方法很耗时耗力,因为每个抗体是串联线性加入,而且目前是手动操作。 更好的选择是选择一种mIF/IHC染色系统,使用与单IHC相同的一抗,经常一抗是未标记的。这使得相同的一抗结合条件(阻断、浓度、稀释剂、温度和时间)可以在做mIF/IHC时重现。如果一抗直接用DNA barcode、半抗原或酶标记,则应重新确定或至少确认结合条件,因为一抗被改变了。一旦敏感性和特异性确定没问题了,一抗应用条件应保持不变。其他考虑因素包括一抗染色顺序、荧光标记选择和其浓度和重复性测试。尽管有额外的步骤要做,但这是将传统的单IHC检测信息应用于mIF/IHC套餐的最佳方法。 4. 病理医生因为传统IHC使用显色染色而不是荧光染色,往往对荧光图像水土不服、比较排斥,如何促进他们对这些新技术的兴趣? 病理医生对荧光的抗拒部分原因是缺乏免疫荧光染色经验和缺乏时间学习。不幸的是,mIF/IHC的复杂性在两方面增加了时间需求。首先,与光学显微镜的传统识别模式不同,多个生物标记物数据需要在多个荧光通道之间来回切换。其次,数字化也有一个习惯过程,也是病理医生面临的一个挑战,他们更习惯于使用手动、普通光学显微镜读片。病理医生在平时的显色IHC工作中习惯于将显色分级为阳性1-3+,但免疫荧光染色具有更大的线性动态范围(意味着更精准的定量分析),病理医生往往对此缺乏经验。不过,通过适当的培训、数据支持的标准阈值方法以及在病理医生中开展这项新技术好处的教育,病理医生可以很快适应mIF/IHC。一旦适应,与单IHC相比,他们会发现这项新技术是帮助他们解决临床诊断工作的强大工具。此外,许多数字病理分析程序现在提供了伪彩色选项,可以通过单独显示每个标记(或其任何组合,如绿色+红色信号=黄色信号)来方便新用户,就像它们在标准数字病理(甚至传统显微镜)图像中出现一样。 5. 我们知道,传统上,病理医生一直以来的读片诊断工作是一种基于经验的定性诊断,病理医生对使用软件进行量化分析往往感到不舒服,这种情况有什么建议? 与视野下的感兴趣区域(ROI)相比,病理医生应用虚拟切片图像的可视化技术(WSI)进行诊断、分级、评分,病理医生基本都此认可和满意,特别是如果能够生成伪彩单一IHC染色的 WSI(见图1)。大多数病理医生应该能够通过单独显示每个标记物染色或一一组合来手动为mIF/IHC 的WSI评分,就像标准数字病理学解决方案一样。这会是一个很好的过渡或适应过程,让病理医生慢慢适应荧光染色、尤其是多种荧光染色,并慢慢了解多重染色的好处和强大。 图1.使用mIF/IHC对正常肝组织的代表性染色图像,及其仿IHC的伪彩图像A. mIF/IHC染色:DAPI(蓝色)、CD3(绿色)、泛细胞角蛋白(红色);B.伪彩IHC:DAPI(蓝色),泛细胞角蛋白(棕色);C. 伪彩IHC:DAPI(蓝色),CD3(棕色);D. 伪彩IHC DAPI(蓝色),放大倍数均为:200倍。 6.开展mIF/IHC工作是否需要暗室? 不需要,可以在标准的病理实验室中进行。使用暗室是选项而非必须的。 7. mIF/IHC的组织厚度是否有特殊考虑? 适当的组织厚度是高质量mIF/IHC图像的关键。适合于mIF/IHC分析的FFPE组织厚度应在4–5μm,通常为一个细胞厚。某些组织类型有不同的切片厚度考虑,例如,大脑和中枢神经系统(CNS)组织切片需要8-10μm厚度来显示神经元。另一方面,在组织样本有限的情况下,如穿刺活检或淋巴结,3μm是可以接受的,但小于2μm的厚度有可能导致不准确的结果。 8. 可以使用现有传统的单一IHC流程进行mIF/IHC组织处理、切片和染色吗? 单一IHC和mIF/IHC的组织处理和切片应在相同条件下进行。mIF/IHC套餐的优化和验证按以下顺序进行:i)传统单一IHC;ii)单一IF(单一免疫荧光);和iii)mIF检测。这些染色都应在连续的组织切片中进行。经验表明,将传统的单一IHC染色转化为mIF染色方案往往都要改变一些东西,例如改变信号检测系统,从而使单一IHC和mIF/IHC两种检测之间获得相同的信号强度⑵。 9.每次染色应处理哪些对照品? 每次染色应进行三个主要对照: 第一个是阳性对照组,它应该代表待检测组织特征。这有助于确定自动染色机是否正确加样了所有试剂,还可以在成像后标准化以减少批次效应,作为标准化一部分。 第二个是同型或特异性对照。所有一抗应替换为非特异性抗体,以显示染色方法中的非一抗试剂对每个通道中观察到的信号的贡献程度。 三是自荧光控制。在不使用任何荧光试剂的情况下揭示组织中的整体自荧光、以及所有试剂的荧光状态,这些试剂不应该直接影响每个通道中的荧光信号。 10. 冷冻样品能否用于mIF/IHC? mIF/IHC通常不在冷冻样本上进行,因为组织结构在新鲜冷冻组织中的保存不如FFPE样本。大脑和中枢神经系统的小鼠研究除外,这些研究主要在切割8-10μm厚的冷冻组织中进行。当然,也有在冷冻样本做mIF/IHC的报道。 11.对于具有挑战性的样本类型有哪些特殊考虑? 骨和中枢神经系统等组织倾向于显示高背景染色,这可能会对某些标记物的特异性和非特异性染色信号分离形成挑战。使用较薄的切片、优化包被、阻断步骤和使用单克隆一抗等,可以减少高背景的可能性。使用选择性抗体稀释液和包被、封闭试剂可以进一步显著降低背景并增强染色强度。 此外,由于高水平的脂褐素,中枢神经系统组织可呈现较高水平的自体荧光。在苏丹红或脂褐素淬灭剂溶液中孵育载玻片有助于缓解这一问题,这些溶液也有助于减少骨髓中的免疫荧光背景染色。自荧光还可以利用多光谱成像和光谱拆解技术进一步解决,允许将自体荧光分离到一个离散通道和每个检测生物标记物通道,而不用考虑荧光强度或光谱重叠,从而提供准确的检测数据和定量信息。 12.如何储存切片和组织块最有利于mIF/IHC? 虽然组织可以以不同的方式保存,但FFPE是医院和研究中心保存临床样本的主要方法。病理行业在福尔马林固定和对FFPE组织中生物分子降解的理解确实有争议。 行业共识是储存载玻片在室温干燥环境下,组织块也是在室温干燥环境下,将其保存在石蜡块中(理想情况下,切割表面覆盖一层石蜡层,以避免组织氧化),并防止光照。保存完好的组织块可成功保存长达10年。此后,可能会发生明显的组织降解,因此在开始任何有关mIF/IHC的回顾性研究之前,应确认10年以上组织块的形态质量(通过H&E)和其抗原性。 尽管载玻片储存方案也存在争议,但共识是使用新切的组织切片,将其4°C储存在载玻片盒内。有些人建议将切好的组织切片存放在干燥的氮气室中(以避免组织氧化),但并非所有实验室都配备氮气室。三个月后,某些标记物的抗原表位会丧失,因此,mIF/IHC的最佳实践是使用不到三个月的切片。 13.在一个通道中混合两个标记是否可行且有用? 可行,在mIF/IHC中实践中还是倾向于不混用,混合应用往往见于下面这种情况:将多个肿瘤/癌症标记物混合到一个通道中,例如,泛细胞角蛋白(pan-cytokeratin)和任何其他细胞角蛋白(如肝脏样本中的CK18),用于确认或排除组织的上皮性质。 14. 合理的mIF/IHC套餐内应该包括多少种生物标志物? 套餐中待检测标志物的数量取决于技术平台和目标。临床应用及临床研究而言,更多并不一定更好。常常,一个包含三个生物标志物的套餐就足够了,例如,泛细胞角蛋白(pan-cytokeratin)、CD45和PD-L1的三重染色就能满足对PD-L1表达的评分⑶。对于一个探索性研究,往往需要更多的生物标志物来发现表达谱,可以考虑使用具有大规模能力的多重荧光染色平台,使用包含较多生物标志物的大套餐。 15.如何组合、匹配一个mIF/IHC套餐里面各个荧光标记?匹配标记、染色化学和成像平台的一些策略是什么? 目标生物标记物的性质、可用的抗体以及荧光标记是主要决定因素⑷。靶生物标记物的表达模式(核、细胞质或膜)、表达丰度(少数至数百个细胞)和每个细胞内的表达水平,以及在非靶细胞中的表达,都是重要的因素。 检测系统、一抗和二抗以及选择的荧光标记分子对于确定最终结果的特异性(信噪比)至关重要。由于最终荧光标记的荧光强度由其发射光强度决定的,经验是将弱荧光标记与丰富或强烈的生物标记物相匹配。 其他决定因素包括先前的优化过程、正确的抗体和荧光抗体浓度。 16.切片染色后成像时,如何检测到批次效应并减轻它? 原始图像中的批处理效应(设置优化后由扫描仪直接生成的批处理效应)由设置的更改或扫描仪的机械特性,例如光源、载物台和校准、载玻片/盖玻片厚度和其他变量决定。检测这些细微差别和批量效应通常需要有经验的技术人员或病理医生提供线索,他们对QA/QC过程的监督对于解决此阶段的批处理效果至关重要,因为原始图像决定了要生成的下一批图像(次图像)。 次图像通常基于参考库和拆解算法生成。由于玻片间的不一致或不正常染色,此类方法可能会出现批错误,因此正确的染色是关键。基于各种荧光标记的丰度和分布的染色变化也可能使算法发生偏差,使其成为批错误的潜在来源。毕竟,算法取决于输入的图像和参考库,无论是合成的还是测量的。 类似地,在对算法进行训练以执行图像分割和评分之后,在图像分析期间也可能会出现批处理效应问题。这涉及到上述所有要点,及人工智能(AI)准确分割和评分的能力。因此,批量效应必须由训练有素的科学家和病理医生团队进行QA/QC,以确定其影响并避免数据报告中出现较大精度错误。 17.可以从现有的、经过验证的流式细胞仪套餐(抗体panel)构建mIF/IHC套餐吗? 可能的,然而,大多数流式细胞仪中使用的抗体与IHC(组织中含石蜡)不相容,很可能是因为细胞悬浮液中抗原的表位呈现可能与IHC组织切片中细胞的抗原的表位或抗原决定簇不同。 在流式细胞术中,荧光标记通常直接与一抗结合。相反,大多数IHC和mIF/IHC方法使用二抗间接标记法,因为往往需要二抗进行信号放大。流式细胞仪抗体在流式细胞术应用中有良好信噪比,但应用于mIF/IHC可能是很大的挑战,因为对于含量较低或表达较弱的蛋白质,信号可能较弱或检测不到。 流式细胞仪和IHC科学家对细胞表型检测也可能有不同的观点。例如,IHC科学家可能只使用FOXP3抗体来鉴定调节性T细胞,而flow科学家通常还包括谱系标记。在将流式细胞仪的抗体panel转换为mIF/IHC套餐之前,建议进行文献回顾并咨询免疫学家和病理学家。 18.是否需要特定设备来实现多重免疫荧光染色?拥有荧光数字病理扫描仪是否就足够? 这取决于检测目标的数量。通过荧光扫描仪,大部分病理实验室配备可以轻松实现四重或四色mIF/IHC。一些荧光扫描仪可以调整以检测多达六个标记。对于超过七种颜色的可视化,建议使用多光谱荧光扫描仪,但不是“必备品”。 19.高效分析mIF/IHC需要考虑哪些因素? 组织微阵列(TMA)是进行mIF/IHC最具成本效益的方法。然而,即使TMA是由病理医生构建的,经过几次切片后,TMA组织的形态和成分也会发生变化。建议在开始mIF/IHC项目之前先进行H&E染色,以确保TMA仍然适用。 在资源相对有限的环境下,mIF/IHC的WSI全切片分析——将是接近实际病理诊断的理想方式。但是,必须小心区分“全切片分析”和“全切片检查”。病理医生确实需要检查整个切片,但不需要量化整个切片。即使关注点在肿瘤区域,生物标记物也往往只在热点区域计分或打分。将正确答案——以及正确的科学问题——置于正确的环境中是取得成功的关键。 目前基于荧光标记的多重荧光组织免疫mIF/mIHC是探测肿瘤微环境应用最广泛的技术,泰立瑞信息专注于mIF/mIHC的相关技术,致力于将免疫染色(mIF/mIHC)、荧光图像采集和分析的自动化和智能化,研发用于mIF/mIHC的全自动免疫组化染色机(TR-Stainer) 和荧光全切片扫描仪(图二),其中TR-sWSI-5F荧光扫描仪是一款轻量入门级产品,具备快速5色扫描功能(蓝色DAPI、绿色FITC、黄色TRITC、红色Cy5、近红外Cy7),满足目前免疫荧光组化的绝大多数临床需求。而TR-sWSI-MF 的多光谱荧光扫描仪((定制化))可以将多达15种颜色和自体荧光彼此得到很好的分离,从而使用户信心百倍地专注于量化真正发生的生物学相互作用,能够在整个切片上同时观察和测量组织的细胞,包括多种细胞表型。 图二:泰立瑞荧光扫描仪(TR-sWSI-5F) 图三:泰立瑞全自动免疫组化染色机(TR-Stainer) 参考文献 1. S Lu et al., “Comparison of biomarker modalities for predicting response to PD-1/PD-L1 checkpoint blockade: a systematic review and meta-analysis,” JAMA Oncol, 5, 1195 (2019). PMID: 31318407. 2. JM Taube et al., “Multi-institutional TSA-amplified Multiplexed Immunofluorescence Reproducibility Evaluation (MITRE) study,” J Immunother Cancer, 9, e002197 (2021). PMID: 34266881. 3. J Yeong et al., “Multiplex immunohistochemistry/immunofluorescence (mIHC/IF) for PD-L1 testing in triple-negative breast cancer: a translational assay compared with conventional IHC,” J Clin Pathol, 73, 557 (2020). PMID: 31969377. 4. ER Parra, “Validation of multiplex immunofluorescence panels using multispectral microscopy for immune-profiling of formalin-fixed and paraffin-embedded human tumor tissues,” Sci Rep, 7, 13380 (2017). PMID: 29042640.返回搜狐,查看更多 声明:该文观点仅代表作者本人。
标签:
×参考诊断