| 图片: | |
|---|---|
| 名称: | |
| 描述: | |
- 右侧肩部
摘要:
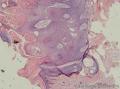
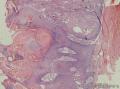
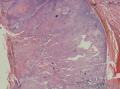
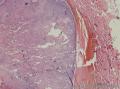
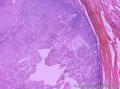
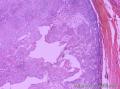
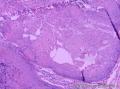
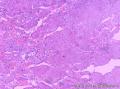
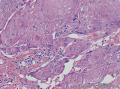
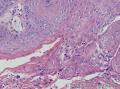
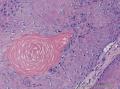
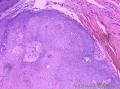
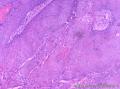
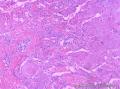
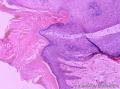
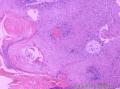
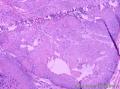
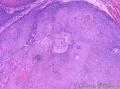
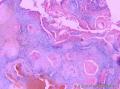
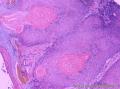
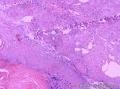
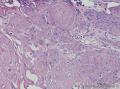
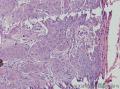
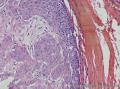
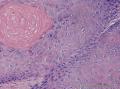
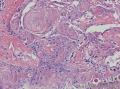
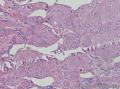
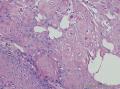
组织病理学上,角化棘皮瘤在镜下呈圆形对称实性肿瘤,具有分化良好的鳞状上皮,几乎没有异型性和间质变,鳞状上皮角化明显,假癌性增生浸润不超过毛囊汗腺水平。但在快速生长期,角化棘皮瘤假癌性浸润无法与鳞癌鉴别,也可见到少量核分裂像,但是核分裂像多限于基底细胞层。退行期,鳞状上皮无增殖活性,很难见到核分裂像,上皮细胞处在变性、坏死和消亡的不同阶段。周围炎细胞浸润,基质纤维化。
1
1.1
1.2
1.3
1.4 染色体异常:染色体异常在角化棘皮瘤中常见,占33.3%(5/15),常见的异常表现为染色体获得8q,1p,9q和缺失3p,9p,19p,19q。多数角化棘皮瘤中的染色体异常未在鳞状细胞癌中发现。异常染色体在角化棘皮瘤的疾病早期和晚期都可见到,说明遗传的不稳定在角化棘皮瘤的发展和消退中都起作用[4]。该研究小组进一步作了角化棘皮瘤和鳞状细胞癌染色体异常的对照研究发现,前者染色体异常比例(37.1%)远远低于后者(83.7%)。染色体获得1p, 14q, 16q, 20q和缺失4p在鳞状细胞癌更常见,统计学有显著差异。染色体缺失9p在角化棘皮瘤更常见。两种肿瘤染色体异常模型不同说明不同的遗传机制在疾病的发展中起作用[5]。染色体获得11q和细胞周期素D1的增加是角化棘皮瘤和鳞状细胞癌疾病早期的必要条件。染色体11q的变异最常见,而且在某些皮肤肿瘤是唯一的变异[6]。其它染色体异常,包括7号单体,2号染色体与8号染色体易位[7-8]。Muir-Torre 综合征患者某些角化棘皮瘤皮损中发现微卫星不稳定性和DNA错配修复基因的突变[9]。
1.4
2.肿瘤来源
角化棘皮瘤早期在人和实验动物上的研究表明,该病起源于毛囊。起源于毛囊上部的角化棘皮瘤临床表现为芽蕾状外观,而起源于毛囊深部或生发中心的角化棘皮瘤表现为圆顶状或浆果状)。有关角化棘皮瘤的组织来源仍不断有报道。日本作者研究了角化棘皮瘤的角蛋白的表达。结果发现,角化棘皮瘤中心K1和K10表达下降,K14和K16在肿瘤细胞中表达。提示角化棘皮瘤皮脂腺在毛囊开口的下方外毛根鞘分化[10]。
3.增殖方面的研究
自90年代起,各国学者对角化棘皮瘤的增殖特征进行了大量的研究。多数研究或按照角化棘皮瘤不同分期或将鳞状细胞癌作为对照进行了研究。
3.1DNA含量测定:用DNA流式细胞学方法未发现角化棘皮瘤和鳞状细胞癌之间DNA含量有显著差别[11]。用DNA image细胞学方法则发现DNA含量在鳞状细胞癌中升高[12-13]。
3.2核仁组成区法研究发现角化棘皮瘤指数低于鳞状细胞癌,并随着鳞状细胞癌的恶性度增高而增高,说明两者不同的生物学本质,但是用于鉴别作用还不够充足[14-15]。
3.3H-ras基因及其蛋白:Ras是第一个被发现的人类癌基因,它的表达产物常称为p21ras,是GPT结合蛋白,具有GPT酶活性,对细胞的生长、分化、等功能产生调节和影响。Ras基因分为H-ras、K-ras和N-ras三种。纽约一研究小组系统的作了关于H-ras和角化棘皮瘤方面的研究。他们首先发现角化棘皮瘤中可以测到H-ras活性,在角化棘皮瘤中的活性高于鳞状细胞癌。在实验动物的进一步研究中发现H-ras的活化既不能导致恶性变也不能够维持良性肿瘤的生长,可能与肿瘤衰退有关[16-17]。而日本学者研究发现H-ras蛋白在汗腺、皮脂腺、毛细血管、寻常疣和角化棘皮瘤中均有表达,推测H-ras与核间变和恶性行为无关[18]。
3.4 PCNA: PCNA是增殖细胞核抗原,其功能是DNA多聚酶δ的辅助因子,除G0期细胞外,其他周期细胞均可检出。90年代至今,不断有PCNA与角化棘皮瘤的研究报道。但是研究结果不尽相同。有些研究认为PCNA在角化棘皮瘤和鳞状细胞癌中的分布不同,PCNA阳性表达在角化棘皮瘤的外周部分,退行期角化棘皮瘤PCNA在基底层的阳性很弱,而鳞状细胞癌包括高分化鳞状细胞癌阳性表达则在肿瘤的全部。PCNA阳性率随着肿瘤恶性度增高而增高,PCNA阳性率比阳性分布模式在鉴别诊断中似乎更为有力。表现为角化棘皮瘤样的鳞状细胞癌PCNA的表达可以出现上述两种模式,无法与角化棘皮瘤鉴别[19-22]。有些研究者发现角化棘皮瘤和高分化鳞状细胞癌相似,只是与中低分化鳞状细胞癌分布不同,PCNA阳性细胞在角化棘皮瘤分布分布在基底层和基底层上,而鳞状细胞癌则分布在除角质层外的各层[23]。
3.5 Ki-67:也是一种细胞增生相关的核抗原之一。所测抗原只表达在G1、S、G2、M期的细胞,G0期细胞不表达。近十余年的多数研究结果比较一致,Ki-67在角化棘皮瘤中的阳性率低于鳞状细胞癌并随鳞状细胞癌恶性程度增加而增加,且分布的模式也不同。角化棘皮瘤中Ki-67阳性细胞分布在肿瘤周边,而鳞状细胞癌中的则分布在肿瘤的全层[24-27]。个别研究结果角化棘皮瘤和鳞状细胞癌表达模式并不是一成不变[28]。
3.6 p53:p53基因及其蛋白是在角化棘皮瘤中研究报道最多的。1983年Levine克隆了p53基因,1989年Vogelstein确定它为抗癌基因。编码393个氨基酸组成的53KD的核内磷酸化蛋白,具有与DNA和蛋白质结合的功能。P53蛋白的功能非常复杂,主要为细胞周期的负调控因子。具有调节细胞周期、诱导细胞凋亡、抑制肿瘤发生和发展的作用。近十余年关于角化棘皮瘤p53的研究结果不尽相同。部分学者发现p53蛋白在角化棘皮瘤中的表达低于鳞状细胞癌中的表达[25,29-30]。部分学者则得出完全相反的结论[31]。多数学者研究结果认为p53蛋白在两病中的表达没有显著性差别[20,32-34]。p53在假上皮瘤样增生、角化棘皮瘤和鳞状细胞癌中表达的研究发现p53均阳性,p53是提示增殖能力,不提示肿瘤或恶性[35]。在研究方法方面,有学者发现用分子病理学方法研究发现p53的突变与免疫组织化学结果不符,建议用分子学方法研究p53,因为p53蛋白中包括野生型p53和突变型p53[36-38]。
3.7 EGFR:EGFR是上皮生长因子受体,与上皮生长因子(EGF)结合,作用于分裂素,影响细胞的增殖和分化。免疫组织化学研究发现角化棘皮瘤和其它良性增生,如寻常疣、脂溢性角化中EGFR染色均匀一致,而鳞状细胞癌则丧失细胞膜的标记和细胞浆的聚集[39]。国内学者应用流式细胞免疫荧光技术对皮肤鳞状细胞癌和角化棘皮瘤各10 例癌、瘤细胞中的EGFR相对含量进行了定量分析, 鳞癌(SCC) 的FI值明显高于角化棘皮瘤( KA) ,两者差异具有非常显著性( t =8 . 732 , P <0.001 ) [40]。
3.8 端粒及端粒酶:端粒酶在角化棘皮瘤中的研究开始于2004年。在对进展期角化棘皮瘤和高分化鳞状细胞癌的对照研究中,发现角化棘皮瘤中端粒酶的活性(17%)远远低于鳞状细胞癌(65%),这种不同的表达可以解释鳞状细胞癌不断增殖,而角化棘皮瘤则寿命很短并自行消退。说明两者是不同的疾病,对鉴别诊断有帮助,但是应用于临床的病理诊断还有局限性[29]。其它研究发现端粒酶相关蛋白(TP1)在角化棘皮瘤和鳞状细胞癌表达模式不同,说明角化棘皮瘤是独立的疾病,有助于两者的鉴别[41]。但是,也有学者对端粒酶催化亚单位研究发现,所有角化棘皮瘤和鳞状细胞癌标本中均可检测到,且与正常表皮的表达模式类似,推测端粒酶在皮肤发生肿瘤过程中未必需要明显增加[33]。
4 凋亡方面的研究
在角化棘皮瘤发病机制研究中,细胞凋亡是除细胞增殖和分化外研究最多的方面。细胞凋亡中,细胞凋亡的基因调控又是研究热点。此外,一些免疫学指标对凋亡的影响也有相关研究报道。
4.1 bcl-2及bcl-2家族:bcl-2是一种原癌基因,是B细胞淋巴瘤或白血病-2基因的英文缩写。Bcl-2在人类定位于第18号染色体。Bcl-2蛋白定位于线粒体内膜上,与线粒体的功能关系密切。线粒体膜的改变使线粒体释放凋亡诱导因子和细胞色素C,激活caspase,然后通过一系列酶级联反应,导致细胞凋亡。Bcl-2蛋白通过组织线粒体内细胞色素C和凋亡诱导因子的释放,抑制细胞凋亡。Bcl-2家族是由bcl-2和一类bcl-2同源的基因组成,其成员由bcl-2、bcl-xl、bad、bak、bcl-xs等。它们共同的特点是各自的分子上都有含有bcl-2的两个同源结构BH1和BH2。在bcl-2家族成员之间通过BH1和BH2形成同源二聚体或异源二聚体,这种复杂的聚合反应可以使得这些分子可以调节彼此的活性,对细胞凋亡起着促进和抑制作用。Bcl-2在角化棘皮瘤中表达下降而在鳞状细胞癌中表达增强,且分布模式亦不同。在进展期角化棘皮瘤bcl-2分布在角化棘皮瘤基底层,在退行期角化棘皮瘤,bcl-2几乎不表达;在鳞状细胞癌中,bcl-2分布在肿瘤的全层[42-43]。但是最近国外也有研究未发现bcl-2 在角化棘皮瘤和鳞状细胞癌中的表达有明显差异[25]。Bax基因是bcl-2家族中主要成员之一。Bax和bcl-2在细胞内的比例决定着细胞是否凋亡,在正常情况下,bcl-2和bax在细胞内保持平衡。如bcl-2增多,形成大量的异源二聚体,细胞则长期存活;如bax增多,形成大量的同源二聚体,促进细胞凋亡。1999-2000年华西医科大学成娘等原位检测了角化棘皮瘤和鳞状细胞癌患者表皮的细胞凋亡、凋亡相关基因bax及bcl-2。结果角化棘皮瘤的细胞凋亡率明显高于鳞状细胞癌,bax与凋亡呈正相关,细胞凋亡为角化棘皮瘤的典型生物学特征,可能在KA的自然消退中发挥重要作用。但两者在凋亡的形态和基因调控方面有相似的特点,所以细胞凋亡不宜作为KA和wSCC鉴别诊断指标[44-45]。Bad能与bcl-2或bcl-xl形成异源二聚体,bad与bxl-xl形成的异源二聚体可阻止bcl-xl对凋亡的抑制,促进细胞凋亡。Bad与bcl-2的结合不能阻止bcl-2对凋亡的抑制。在角化棘皮瘤中可见到bad强而弥漫的染色,而鳞状细胞癌只显示弱阳性[46]。Bak是bcl-2的同源拮抗体,bak具有促进细胞凋亡的作用。在角化棘皮瘤中bak的表达是增加的[43]。
4.2 M30:凋亡是通过自身细胞内蛋白质裂变来实现的,调节这一过程的蛋白酶称为半胱氨酰-天冬氨酸蛋白酶(caspase)。后者表达为酶基因,被不同的凋亡诱导剂激活。M30抗体可识别caspase裂变细胞角蛋白18(CK18)的特异性位点,而在正常细胞和坏死细胞中检测不到。采用M30单克隆抗体可特异性检测上皮细胞早期凋亡。Batinac T的研究发现,在退行期角化棘皮瘤中M30表达增加,与bak和granzyme B高度相关[47]。
4.3 CD4、CD8、IL-2受体、IL-10、GM-CSF等:10年以前的一些学者研究发现CD4在角化棘皮瘤皮损中增多,可能是通过IL-2受体增加来实现,推测角化棘皮瘤的消退与CD4有关,并在其他一些可以自然消退的恶性肿瘤中发现此现象,如恶性黑素瘤和基底细胞癌[48-49]。新近的研究发现CD8在角化棘皮瘤的消退中起到最重要的作用[50-51]。2004年哈尔滨医科大学尤刚等探讨了角化棘皮瘤皮损中T淋巴细胞与细胞凋亡及其意义。发现KA凋亡率CD8阳性率呈显著正相关。有学者在做角化棘皮瘤和鳞状细胞癌的对照研究中发现,IL-10在角化棘皮瘤中增高,而GM-CSF则下降,IL-2、IFNα、IL-13、TGF-beta、IL-8和TNF无明显差异。提示免疫抑制使角化棘皮瘤细胞生长、分裂和死亡,无法达到永生,发生恶性变[52]。
5.细胞周期方面研究:
细胞增殖是指细胞分裂和再生的过程。细胞增殖与分化贯穿生命的全过程。通过胞外信号的调控,以及胞内的级联反应进行精细调控,使细胞增殖呈周期性有序地进行。细胞周期是指单个母细胞分裂变成下一代子细胞的过程。即,细胞从上一个细胞分裂结束到本次分裂终了的过程。细胞周期的调控系通过细胞的周期素(cyclins),随细胞周期不同时相进行合成和降解,细胞周期依赖性蛋白酶(cyclin dependent kinase, CDK)有序地磷酸化和去磷酸化,以及CDK抑制物(cyclin dependent kinase inhebitors,CKIs)与CDK结合,负调控CDK的活性等来进行。
5.1周期素:周期素A、周期素B、周期素D和周期素E在角化棘皮瘤中的研究均有报道。研究较多的是周期素D和周期素E。周期素D与角质细胞瘤变或恶变早期相关[6,33,53],在角化棘皮瘤和鳞状细胞癌组织未发现明显差异。周期素E在角化棘皮瘤中的表达高于鳞状细胞癌,周期素E的下调可能与角质细胞恶变有关[53]。国内学者发现进展期角化棘皮瘤中周期素E的表达高于消退期角化棘皮瘤[54]。周期素A和周期素B在角化棘皮瘤和鳞状细胞癌中的表达模式不同但平均表达水平总体没有差异,研究者认为角化棘皮瘤是鳞状细胞癌的一个亚型[55]。
5.2 CDK:对CDK1(p34cdc2)在角化棘皮瘤和鳞状细胞癌中表达模式、分布和平均表达水平均无差异[55]。
5.3 CKI:它是一组分子量较小的能抑制CDK活性的功能蛋白,在细胞周期的适当时间点,能负调控CDK活性而控制细胞周期进程,从而抑制肿瘤发生。所以这类基因也属于抑癌基因。目前发现的CKI有p21(WAF1/CIP1/Sdil/PICI)、p20(CAP)、p27(KIPI)、p16(INK4A/CDKN2/MTS2)及p15(INK4B/MTS2)等。在针对不同时期角化棘皮瘤的研究中发现,p27在消退期角化棘皮瘤中的表达显著高于进展期角化棘皮瘤,统计学处理有显著差异。证实p27对角化棘皮瘤的消退起作用[54,56]。P21在不同时期角化棘皮瘤表达无差别[54],在角化棘皮瘤和鳞状细胞癌中表达模式不同,前者阳性部位分布在基底层和基底层上部,后者阳性部位分布在肿瘤增殖部分,p21在角质形成细胞瘤变中起到某些作用,可能与癌变不直接相关[57-58]。在角化棘皮瘤实验动物的研究中,p21的升高有利于停止增殖促进分化[59]。有关P16的一研究显示p16在角化棘皮瘤和鳞状细胞癌中未发现有显著差异[60]。而另两项研究则中发现p16在鳞状细胞癌中的表达较在角化棘皮瘤中的表达下降[33,61]。
6肿瘤细胞扩散机制研究
6.1细胞黏附和细胞黏附分子:细胞黏附分子(cell adhesion molecules CAM)是众多接到细胞间或细胞外基质间相互接触和结合的分子统称。黏附分子以受体-配体结合形式发挥作用,是细胞与细胞间,细胞与基质间,或细胞-基质-细胞间发生黏附,是参与细胞识别,细胞的活化和信号传导,细胞的增殖与分化,细胞的伸展与移动,是炎症发生,肿瘤转移以及创伤愈合等病理过程的分子基础。根据其结构特点可分为五类:整合素家族、钙黏蛋白家族、免疫球蛋白超家族、CD44和选择素家族。
6.1.1钙粘蛋白家族:在人类至少有10种钙黏蛋白,常见的有E-钙黏蛋白、N-钙黏蛋白和P-钙黏蛋白。钙黏蛋白与细胞内连环蛋白(catenins)结合,后者在于细胞浆内骨架蛋白相连。针对角化棘皮瘤和鳞状细胞癌的对照研究发现E-钙黏蛋白在角化棘皮瘤中阳性率高于鳞状细胞癌[62-63]。经典的角化棘皮瘤的E-钙黏蛋白与正常皮肤及高分化鳞状细胞癌表达一致,而交界的角化棘皮瘤和低分化鳞状细胞癌的E-钙黏蛋白表达一致,后一组E-钙黏蛋白表达更不正常。说明E-钙黏蛋白和生物学行为相关[64]。
6.1.2 CD44:CD44在表皮肿瘤与转移侵袭无关,与分化有关,并发现角化棘皮瘤中CD44表达高于鳞状细胞癌,其下调可能在恶变中起作用,与生物学行为相关[65-66]。
6.1.3 细胞间黏附分子(ICAM-1)和血管细胞黏附分子(VCAM):属于免疫球蛋白超家族,具有与Ig相似的结构特征故名。研究发现ICAM-1和VCAM在成熟期角化棘皮瘤中表达,但是在进展期和消退期角化棘皮瘤几乎不表达。ICAM-1和VCAM在高分化和低分化鳞状细胞癌均表达,低分化鳞状细胞癌的表达强于高分化鳞状细胞癌。说明ICAM-1和VCAM 在角化棘皮瘤中的表达与角化棘皮瘤的疾病进展有关,而在鳞状细胞癌则与分化不良相关。对疾病的生物学特征有辅助的预示作用[67]。
6.2蛋白水解酶类:基质金属蛋白酶(matrix metalloprpteinase,MMP)是细胞外基质降解过程中必不可少的酶类,几乎能降解细胞基质的所有成分。共有20种,并在肿瘤发病各个阶段起作用。角化棘皮瘤和鳞状细胞癌中MMP-2,-7,-8,-9,-10,-13,-19和p16的检测发现MMP19和p16在角化棘皮瘤中的高表达可帮助鉴别两病。同时发现角化棘皮瘤中MMP13的表达提示该疾病不是良性肿瘤而是不完整的鳞状细胞癌。MMP2在肿瘤中均无表达,MMP-7,-8,-9,10在两病中均有不同程度表达[61]。对MMP11的研究则发现,鳞状细胞癌中MMP11的表达高于角化棘皮瘤,说明MMP11与疾病预后有关[68]。
6.3糖蛋白:多配体聚糖-1(Syndecan-1):是一种乙酰硫酸蛋白聚糖,调节细胞间和细胞与基质之间的黏连。角化棘皮瘤中所有角质形成细胞多配体聚糖-1染色呈均匀一致的阳性,高分化鳞状细胞癌的80%细胞和低分化鳞状细胞癌的所有细胞均不染色。所以,多配体聚糖-1是一个有助于鉴别角化棘皮瘤和高分化鳞状细胞癌的标志物[69]。
6.4细胞间连接结构:桥粒密度和桥粒芯桥蛋白:电镜研究发现角化棘皮瘤中桥粒密度变大,而鳞状细胞癌则降低[70]。桥粒芯桥蛋白(Dsg)是构成桥粒的一种主要的跨膜糖蛋白,存在3种基因型Dsg1、2、3。Dsg3 主要分布于正常表皮细胞层上部,被认为系落叶型天疱疮的主要靶抗原。研究发现角化棘皮瘤中Dsg1+2与正常表皮表达一致,但在鳞状细胞癌却明显减少或消失。桥粒芯桥蛋白的减少和消失,致使细胞间黏附力下降,有利于癌细胞从原发瘤分离再向周围组织侵袭[71]。另一研究发现Dsg在角化棘皮瘤上皮中弥漫染色,在高分化鳞状细胞癌仅局部染色,而中低分化鳞状细胞癌则无染色。提示,Dsg可能对鉴别两者有价值[72]。2004年涂平等对角化棘皮瘤和鳞状细胞癌中桥粒芯糖蛋白1表达的研究发现Dsg1在角化棘皮瘤和鳞状细胞癌中的表达类型和强度完全不同,角化棘皮瘤均表现为非角化区表皮层胞膜连续线状棕黄色强阳性染色,进一步证明KA的良性生物学行为[63]。
6.5基因调节:nm23基因(non-metastasis 23
gene)是1988年由美国国立癌症研究所的Steeg等首先在黑色素瘤细胞系中分离得到的一种与肿瘤转移有关的抑制基因。目前有关nm23在角化棘皮瘤和鳞状细胞癌中的有限的国内外两篇报道均未发现nm23在两病中的表达存在显著差别[73-74]。
小结:

- 人如其名
-
liguoxia71 离线
- 帖子:4174
- 粉蓝豆:3122
- 经验:4677
- 注册时间:2007-04-01
- 加关注 | 发消息
-
hetangyuese 离线
- 帖子:189
- 粉蓝豆:33
- 经验:278
- 注册时间:2011-08-03
- 加关注 | 发消息