首先对作者和杂志社表示感谢和敬意!非常值得学习,向新手朋友们推荐: 临床与实验病理学杂志 J Clin Exp Pathol 2005Feb;21(1)
乳腺活检中热点问题的新认识(一)
龚西騟
[关键词] 乳腺;导管内增生性病变;免疫组织化学
乳腺活检中热点问题多半也是诊断中的难点。经过近10多年的探讨,对其中一些问题逐渐形成以下共识或相近的观点。
1 关于定向干细胞及其分化过程
绝大多数乳腺增生性疾病实质上是终末导管小叶单位(TDLU)成分的增生,尤其是TDLU的终末导管(TD)和小管(DTL)上皮细胞的增生。尽管由此引起的病变或疾病的形态学、免疫表型、生物学行为的表现多样,但均与乳腺定向干细胞的增生、分化和转分化(transdifferentiation)密切相关。
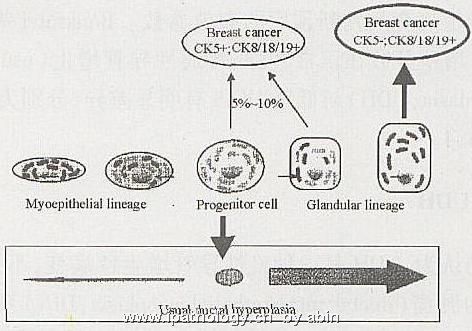
长期以来,公认的乳腺导管和小叶的TD/DTL的衬覆细胞有2种,即腺上皮细胞和肌上皮细胞。然而,新近的研究表明,还存在着定向干细胞及其向腺上皮和肌上皮分化的中间细胞[1~14]。
乳腺的定向干细胞(committedstemcell):也称前驱或成年干细胞(progenitor or adult stem cell)。它仅表达CK5[1~4]或CK5/6[5~10],具有多向分化潜能,可分别沿腺细胞系(line-age)或肌上皮细胞系分化。它存在于正常乳腺及普通性导管增生病变中。
腺前驱或腺中间细胞(glandular precursor or intermediate cell):既表达CK5/6,也表达CK8/18/19。在免疫荧光双标中,它可显示介于CK5(绿色)与CK8/18/19(红色)之间的中间色(黄色)[4]。它反映的是CK5由强到弱,CK8/18/19由弱到强的过程。这种细胞对CK1/5/10/14(克隆号34βE12)也表达[5,10~12]。它存在于正常乳腺及普通性导管增生病变中。
腺终端细胞(glandular end cell):仅表达CK8/18/19,它存在于正常乳腺和各种增生性病变及90%乳腺癌中。
肌上皮前驱或中间细胞(myoepithelial precursor or inter-mediate cell):既表达CK5/6,也表达SMA。在免疫荧光双标中,它可显示介于CK5(红色)与SMA(绿色)二者之间的中间色(黄色)[4]。它反映的是CK5由强到弱,SMA由弱到强的过程。它存在于正常乳腺及所有导管内增生性病变中。与腺中间细胞不同,它位于正常TD/DTL及增生性病变的外层或近基膜侧。
肌上皮终端细胞(myoepithelial end cell):仅表达SMA(或其它肌上皮标记)。它存在于正常乳腺TD/DTL和增生性病变的外层或近基膜侧,不见于乳腺微腺性腺病和浸润癌。
定向干细胞的分化过程可用图1表示如下。
值得注意的是:①乳腺大汗腺化生细胞和柱状细胞变的柱状细胞均不表达CK5和CK34βE12[1,6,10];②不典型导管增生(atypical ductal hyperplasia,ADH)和导管原位癌(ductal carcinoma in situ,DCIS)均不表达CK5和CK34βE12,小叶性不典型增生和小叶原位癌的细胞不表达CK5,但表达CK34βE12;③有作者发现,仅表达CK5/6的现象,只出现在常规石蜡切片中,在同组织的冷冻切片中不出现,并因此对认定仅表达CK5/6的细胞即为定向干细胞的说法表示怀疑[13]。
2 关于增生和导管内增生
增生(proliferation,hyperplasia)是指细胞数量增多引起相应组织的增大,导管内增生是指TD/DTL内上皮细胞增多和TD/DTL的增大。以往把TD/DTL壁衬覆上皮细胞≥3层作为判断有增生的标准,并重视局部细胞增生向管腔内突入或充填管腔的组织学构型(architecture)变化,例如普通性增生的细胞桥、细胞簇、真乳头和实性细胞团;不典型增生/原位癌的实性细胞团、筛状细胞团、微乳头、细胞拱桥和罗马桥等,且依上述特点结合细胞形态制订出不同增生病变的诊断标准。
但现已确认,上皮细胞增生可不显示衬覆上皮细胞层次的增多,而仅表现为单层(腺)上皮细胞衬覆增大的TD/DTL;或虽有细胞层次增加,但不形成明显的突入或充填管腔的构型变化,保持衬覆细胞平坦的复层状,TD/DTL的固有管腔保存。例如平坦型上皮不典型病变。对此类病变的判断不能沿用以往的诊断标准。
TD/DTL内增生依然可被分为导管性(ductal)和小叶性(lobular)2大类,但其内涵已不再是当初的不同解剖组织部位起源的概念,而仅是表达两者在细胞学、组织构型和免疫表型上有不同。因此,不管字面上如何描述,其实际含义均应为导管型(ductal type)和小叶型(lobular type)增生。
有意义的细胞增生是诊断增生性疾病/病变的必需条件。细胞增多受细胞增殖和细胞丢失(例如凋亡)两方面的影响。当增殖占优势时细胞数量增加。增殖指数(PI)和核分裂象指数(MI)有助于判断细胞增殖活性。然而,细胞增殖可以是非肿瘤性的或肿瘤性的,不同疾病/病变的增殖活性差异很大。在认清不同性质增生的细胞学、组织构型、甚至免疫表型的基础上,PI和MI可以成为诊断不同的TD/DTL内增生病变及判断预后的有效参数。Bálvi等[12]发现,MIB1增殖分数在正常乳腺、普通性导管增生(usual ductal hyperplasia,UDH)与低级DCIS有明显差异,分别为1.83、2.41及8.4。
3 关于UDH
目前认为,UDH是一种良性导管增生性病变,不列入导管上皮内肿瘤(ductal intraepithelial neoplasia,DIN)系列[1]。其本质是一种“定向干细胞病变”[4],或者说是一种以定向干细胞及其分化的腺中间细胞和腺终端细胞为主,杂有肌上皮中间细胞和肌上皮终端细胞乃至大汗腺细胞的增生性病变[4~12]。
这种新认识,既可解释UDH的细胞学特征,如多种细胞、(腺性)上皮细胞及其细胞核的多样性和无不典型性等;也可解释其组织构型,如细胞(核)的流水状或漩涡状排列及大小、形态不一、边缘参差、裂隙样窗孔等;并为通过免疫组化检测协助UDH诊断及与ADH/DCIS鉴别提供了理论依据。
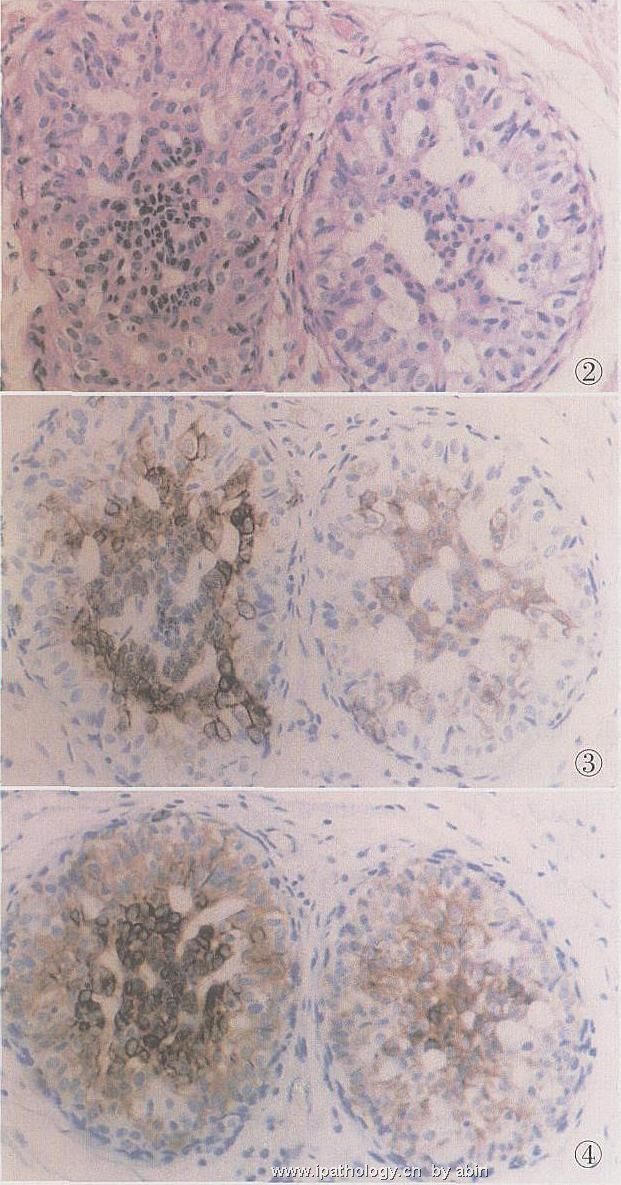
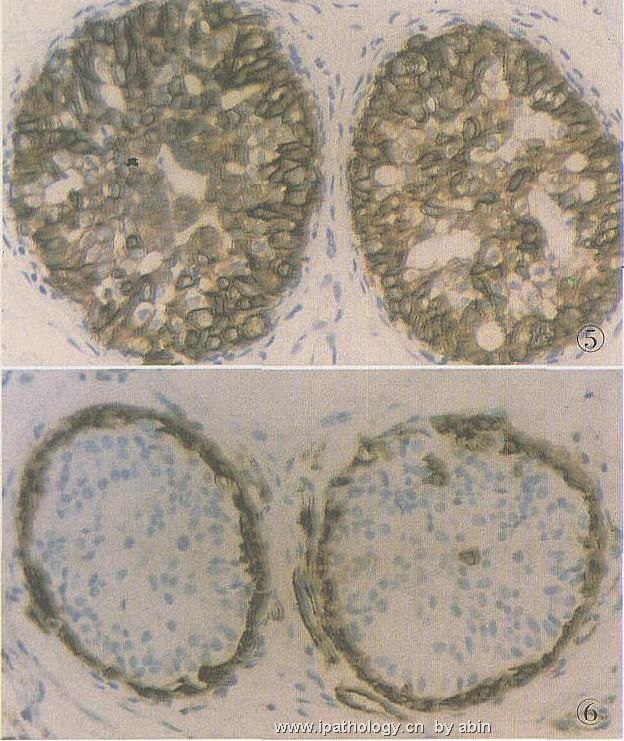
一系列的研究证实,UDH显示高分子量CK呈拼花状或弥漫性阳性。由于总是有腺终端细胞及肌上皮终端细胞的存在,因此在相应部位会显示低分子量CK,如CK8/18/19阳性及SMA阳性。简而言之,在免疫组化检测时,UDH显示CK5或CK34βE12与CK8/18/19的镶嵌式阳性表达;在免疫荧光双标中,它显示绿(CK5)、黄(CK5及CK8/18/19)和红(CK8/18/19)的色彩并存。SMA阳性的肌上皮细胞总存在于外周部位(图2~6)。
值得注意的是:①应用免疫组化结果解释增生性病变时,HE图像依然是诊断和鉴别诊断的基础。②在不同增生性病变中,CK5和CK34βE12的阳性表达或不表达,均非100%(表1),而且CK5与CK34βE12之间并不完全一致。③要注意CK5或CK34βE12阳性细胞的强度及数量。在1型ADH和以1型ADH量化(总横切面直径>2mm)诊断的DCIS中,由于有少量正常小管上皮或UDH的存在,可能出现少量的CK5或CK34βE12阳性表达。在UDH中,因为有腺终端细胞和(或)大汗腺上皮及柱状细胞的存在,CK5和CK34βE12可出现灶性阴性。④CK5和CK34βE12的阳性表达,不会改变高(核)级DCIS的HE诊断。因为高(核)级DCIS可以直接发生并不经过ADH。此外,在高(核)级DCIS发生导管内扩散形成导管内扩散癌(intraductal spread carcinoma,ISC)时,其原有导管或增生的导管上皮依然可以表达CK5及CK34βE12。
表1 CK5、CK34βE12在不同TD/DTL内增生病变中的表达[10]
CK UDH(%) ADH(%) DCIS(%) LCIS(%)
34βE12 +++(90~100) -/+(80~90) -/+(81~100) +++(80~100)
5/6 +++(88/100) -/+(80/92) -(96~100) -(83~100)
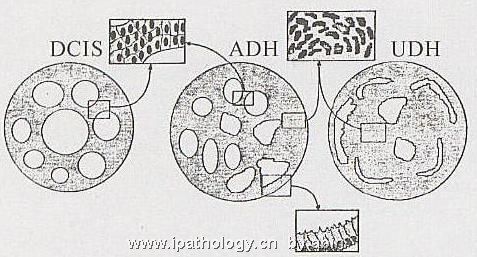
值得一提的是,UDH的窗孔习惯上称为次级或二级管腔,其实这是一种误解。它是导管/小管固有腔或“一级”管腔被增生细胞分隔的结果。在横切面上它们似乎与固有管腔不通,但从立体观察,均与“一级”管腔相通。这是它与低级DCIS的“筛孔”不同之处,后者是新的肿瘤性管腔。识别这些腔的不同特征(图7),有助于鉴别诊断。
4 关于不典型性和不典型增生
不典型性(atypicality)或异型性(atypia,atypism)是指肿瘤在组织学和细胞学方面与其相应正常组织间存在的差异。这种差异可表现为组织学构型的变异、细胞的多形性和核的异型。尽管异型性的大小在不同肿瘤可以差异很大,自很轻微到很明显,但它的有或无却是区别良性增生和肿瘤性增生的重要依据,尤其是明显的细胞多形及核异型常是诊断恶性肿瘤的形态学依据。然而在乳腺经典型小叶性肿瘤和低(核)级导管内增生性病变中,细胞的单一性(monotonous)和一致性(uniform)及轻微的核/质比例增大,却是最突出的细胞学不典型性;而细胞分布的均匀性及一些特殊组织学构像则是其特征性的组织学异型性。这两者的结合是诊断和鉴别诊断的依据。
1985年,Page等[15]在对仅做过乳腺活检、经长期随访的10542件标本进行回顾性研究后指出:在原位癌(carcinoma in situ,CIS)和无原位癌特征的上皮增生之间,存在着一类“具有CIS的部分但不是全部特征的病变”,他称之为不典型性增生(atypical hyperplasia,AH),包括不典型性“导管”增生(atypical ‘ductal’ hyperplasia,ADH)和不典型性小叶性增生(atypical lobular hyperplasia,ALH)。但与此前一些病理学家(包括Page本人)使用AH,在该文中Page把AH严格限定在:①具有CIS的部分但不是全部(缺少任何1项)特征的(低核级)增生性病变;②具有(低核级)DCIS全部特征,但范围仅限于1个管腔或不足2个分隔的管腔的“导管性”增生性病变;或具有LCIS特征但累及范围未达到小叶大部分小管的小叶性病变。
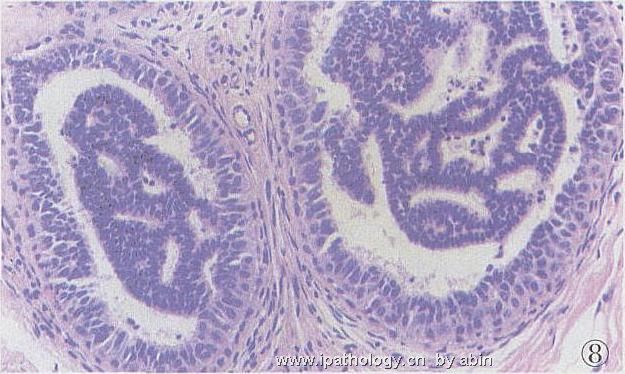
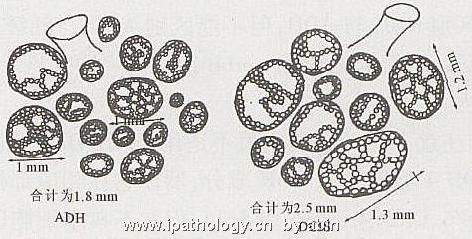
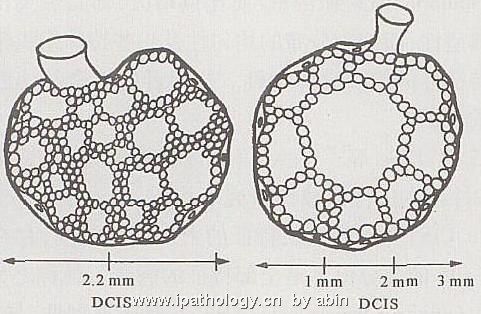
1999年,Tavassoli等[2]把ADH分为两型:1型,单一的不典型的细胞增生显示典型UDH的任何构型(图8),或单一性细胞灶性聚集混杂有UDH;2型,纯粹由单一的不典型细胞组成,并显示1种或多种经典DCIS的构型,但仅累及单个管腔的一部分,或累及多个TD/DTL而其合计横切面的直径<2mm(图9,10)。笔者理解:ADH1型为质不纯,ADH2型为量不足。Tavassoli认为,如果在ADH2型中出现坏死,则应视为DCIS。2001年,Rosen[3]指出,无论是Page还是Tavassoli,诊断ADH的量化标准都是人为的。因为没有关于累及1个、2个、3个导管的横切面,或病灶直径为1.5、2.0、2.5mm的比较研究的报道。
2003年WHO乳腺肿瘤分类中[1]将ADH定义为“一种肿瘤性导管管内病变以均匀分布的单形性细胞为特征,伴有中度进展为浸润癌的风险”,其形态学特征为“通常具有卵圆形或圆形核的单形性细胞增生,细胞分布均匀,可形成微乳状、簇状、茎状、拱形、僵硬的桥状、实体状和筛状等构形,其细胞学相当于低级DCIS。”该分类指出:当特征性细胞和UDH共存和(或)当经典性形态部分地累及TDLU时,均可诊断为ADH。前一种情况与Tavassoli的ADH1型相同,后一情况则比Page或Tavassoli的说明更模糊。至于是否采用量化标准以区别ADH与低级DCIS,该分类指出“目前尚未形成共识”,并同时列出了Tavassoli和Page的各自标准。这意味着,至少在近期内,在HE染色片内如何区别ADH与低级DCIS会形成标准不一的局面。笔者赞同Tavassoli的量化标准。
2004年,Koerner[5]指出,Page对AH的概念是正确的,但定义却是模糊的,因为它既未指明哪些是AH必需有的特征,哪些是可以缺少的特征。Koerner主张把ADH定义为“显示低级细胞学不典型性但缺乏有意义的组织学构型不典型性的导管性增生”。笔者理解,Koerner的定义近似于Tavassoli的ADH1型,但Koerner不倾向于使用Page或Tavassoli的量化标准,而宁愿把诊断建立在纯形态学发现上,将此类病变作为独立属性的病灶来描述其大小。对不符合Page或Tavassoli量化标准的病变,称之为“显微镜下导管原位癌灶(microscopic focus of ductal carcinoma in situ)”。笔者认为,使用该诊断宜慎,因为可能引起治疗过度。
与UDH相反,90%的ADH不表达CK5/6、CK34βE12或CK5/14。通过采用免疫组化或免疫荧光标记以检测上述标记物,可区别UDH与ADH,但不能区别ADH与低级DCIS。ADH不表达p53,罕见表达c2erbB22,27%~59%显示cyclinD1过表达。
应当注意:①2mm的阈值不适用于TD/DTL纵切面病变;②ADH1型因杂有UDH成分,所以它在相应部位可以表达CK5/6、CK34βE12或CK5/14,但在不典型细胞区应为阴性;③ADH2型对CK5、CK34βE12基本不反应;④在HE结合免疫组化仍难以区分ADH与低级DCIS时,宜偏向ADH;⑤应提醒临床医师,ADH患者适合行包括肿块在内的区段切除术及随访。单就ADH本身并不是切除乳房的适应症。
5 关于DCIS
目前认为,DCIS是一种肿瘤性导管内病变,特征为上皮细胞明显增生,细胞有轻至重度异型,有发展为浸润癌的趋势,但并非必然。它是一组在表现模式、组织病理学形态、生物学特征和发展为浸润癌等方面均呈高度异质性的病变。
Koerner[5]认为,低级DCIS体现肿瘤性腺形成细胞(neoplastic gland forming cells)的增生。正因为如此,此种癌细胞具有重演腺或小管结构倾向,并有细胞间黏附性降低,从而产生了低级DCIS的构型和细胞学特征。
与正常腺上皮细胞相仿,低级DCIS癌细胞也可显示细胞极化(cellular polarization)现象。所谓细胞极化现象,是指细胞的亚细胞区(subcellullar regions)呈现不同形态和功能的有机组合状态。例如腺上皮极化,表现为细胞核位于细胞的近基膜区(基极basal pole),胞质聚集于核的对侧端(顶极apical pole),形成顶部胞质区(apical cytoplasmic compartment)。低级DCIS中具有极化现象的癌细胞可形成新的腺腔。当肿瘤细胞团内出现大量新腺腔时,镜下其横切面可见大量形态一致、圆形、冲凿状的空腔,腔间为大量均匀分布、形态单一的癌细胞,使癌细胞团呈筛状,习惯上称这些腔为筛孔。筛状结构是低级DCIS组织构型的不典型性表现之一,其它如小梁性栅栏状(trabucular bar)、银币状(cartwheel formations)以及罗马桥状(Roman bridges)等构型均为筛状结构的变型,都与肿瘤细胞的极化现象有关。
单一的细胞及其核的均匀性分布是低级DCIS的另一个组织构型不典型性的表现。这种特点在辨认微乳状及实体型低级DCIS时有着重要的意义。
低级DCIS的细胞学不典型性表现为:胞界清楚,胞质苍白或嗜伊红染细颗粒状,核形规则,轮廓平滑,呈圆形或卵圆形,染色深,核仁极罕见。
Koerner的总结性意见为:UDH既无细胞学也无组织构型不典型性,ADH有细胞学不典型性但无组织构型不典型性,低级DCIS具备细胞学和组织构型的双重不典型性。对于具备明显细胞学不典型的病变即归入高级DCIS,此时可以不顾及其它特征。
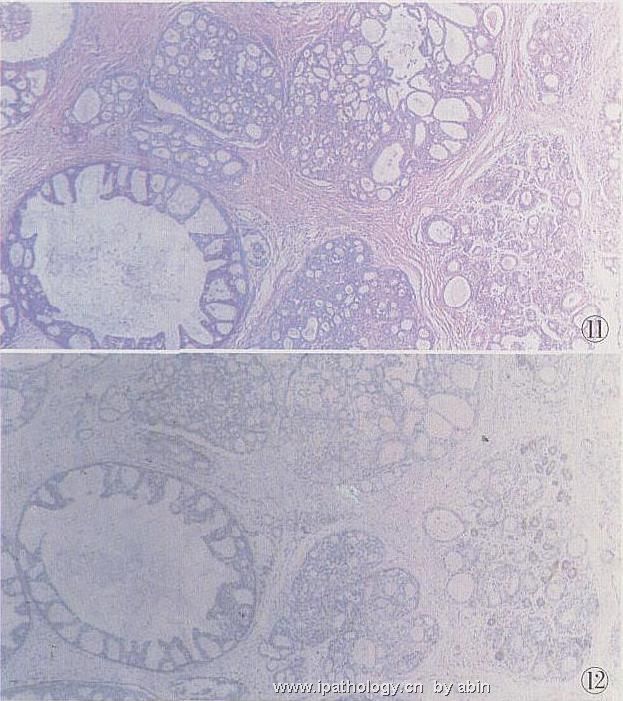
DCIS对CK5或CK5/6、CK34βE12均不表达,仅表达CK8/18/19(图11~15);42%~60%表达c2erbB22,其中粉刺型DCIS69%阳性,非粉刺型18%阳性,微乳头型和筛状型常阴性[3];10%~37%DCISp53阳性,主要见于高级或粉刺型,低核级DCIS罕见阳性;E2cadherin对鉴别实体型低级DCIS与LCIS有价值,前者阳性,后者阴性。
2002年,Megha等[16]依据免疫组化检测结果把DCIS和IDC分为2种表型:①干细胞表型(stem cell phenotype),表达CK8、CK14、CK18、vimentin、EGFR和p53,不表达bcl22、ER和PR。13例中,差分化9例,中分化4例。②腔细胞表型(luminal cell phenotype),表达CK8、CK14,少数表达CK18,不表达vimentin和EGFR,p53多数为阴性,但bcl22、ER和PR表达。38例中,31例为中分化,7例为高分化。MIB1增殖细胞数在2个表型间差异明显,在干细胞表型分别为DCIS 63.5%、IDC 69%,在腔细胞表型DCIS为19.6%、IDC为18.9%。
图1 乳腺上皮细胞分化的假设模式图[4]
图2 UDH,细胞形态多样,可见形态不规则及裂隙样空腔(窗),左侧小管中央部有少数小细胞,核深染
图3 UDH,同上例,小管中央部CK5呈拼花样阳性,强弱不等,S2P法
图4 UDH,同上例,左侧小管中央部CK34βE12强阳性,周边部及右侧小管呈中~弱阳性,S2P法
图5 UDH,同上例,CK8呈弥漫性强阳性,杂有弱阳性及阴性细胞,S2P法
图6 UDH,同上例,小管周边部SMA强阳性,右侧小管内散在少数细胞阳性,S2P法
图7 导管内增生性病变不同形态的腔管模式图[14]旺炽型UDH的腔呈不规则形、裂隙状,腔缘不整,其间细胞核可呈漩涡状,ADH可有UDH及DCIS两者的腔;DCIS腔圆、冲凿状,其间细胞单一,分布均匀。
图8 ADH1型,小管中央部单一小细胞,核小、深染、形态单一,核长轴与腔垂直,呈不典型筛状,周边部为单层至复层细胞
图9 测量病变小管直径模式图[2]左图示TDLU内2个筛状小管,总横切面直径<2mm;右图示TDLU内2个筛状小管,总横切面直径>2mm
图10 测量病变小管直径模式图[2]示明显展开的小管呈筛状构型,细胞单一,病灶横切面直径>2mm[2]
图11 低级DCIS,左下为低级DCIS灶,呈拱状,细胞小、单一,中部为UDH,右侧有一TDLU,部分小管UDH
图12 同上例,左下低级DCIS灶CK5阴性,右侧TDUL呈灶性阳性,S2P法
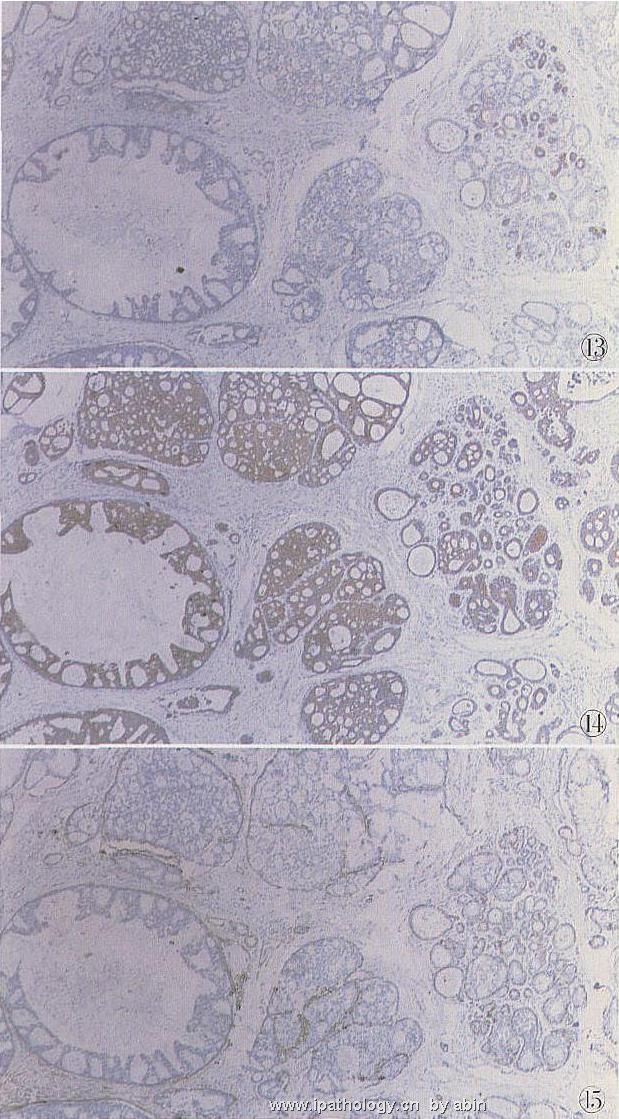
图13 同上例,左下低级DCIS灶,CK34βE12阴性,中部UDH及右侧TDLU呈灶性阳性,S2P法
图14 同上例,左下低级DCIS灶及中部UDHCK8弥漫阳性,右侧TDLU大部分小管呈中等阳性,少数阴性,S2P法
图15 同上例,左侧1个低级DCISSMA表达不明显,余均见强表达,S2P法
名称:图1
描述:图1
名称:图2
描述:图2
名称:图3
描述:图3
名称:图4
描述:图4
名称:图5
描述:图5
名称:图6
描述:图6
名称:图7
描述:图7
名称:图8
描述:图8
名称:图9
描述:图9
首先对作者和杂志社表示感谢和敬意!非常值得学习,向新手朋友们推荐:
临床与实验病理学杂志 J Clin Exp Pathol 2005Feb;21(1)
乳腺活检中热点问题的新认识(一)
龚西騟
[关键词] 乳腺;导管内增生性病变;免疫组织化学
乳腺活检中热点问题多半也是诊断中的难点。经过近10多年的探讨,对其中一些问题逐渐形成以下共识或相近的观点。
1 关于定向干细胞及其分化过程
绝大多数乳腺增生性疾病实质上是终末导管小叶单位(TDLU)成分的增生,尤其是TDLU的终末导管(TD)和小管(DTL)上皮细胞的增生。尽管由此引起的病变或疾病的形态学、免疫表型、生物学行为的表现多样,但均与乳腺定向干细胞的增生、分化和转分化(transdifferentiation)密切相关。
长期以来,公认的乳腺导管和小叶的TD/DTL的衬覆细胞有2种,即腺上皮细胞和肌上皮细胞。然而,新近的研究表明,还存在着定向干细胞及其向腺上皮和肌上皮分化的中间细胞[1~14]。
乳腺的定向干细胞(committedstemcell):也称前驱或成年干细胞(progenitor or adult stem cell)。它仅表达CK5[1~4]或CK5/6[5~10],具有多向分化潜能,可分别沿腺细胞系(line-age)或肌上皮细胞系分化。它存在于正常乳腺及普通性导管增生病变中。
腺前驱或腺中间细胞(glandular precursor or intermediate cell):既表达CK5/6,也表达CK8/18/19。在免疫荧光双标中,它可显示介于CK5(绿色)与CK8/18/19(红色)之间的中间色(黄色)[4]。它反映的是CK5由强到弱,CK8/18/19由弱到强的过程。这种细胞对CK1/5/10/14(克隆号34βE12)也表达[5,10~12]。它存在于正常乳腺及普通性导管增生病变中。
腺终端细胞(glandular end cell):仅表达CK8/18/19,它存在于正常乳腺和各种增生性病变及90%乳腺癌中。
肌上皮前驱或中间细胞(myoepithelial precursor or inter-mediate cell):既表达CK5/6,也表达SMA。在免疫荧光双标中,它可显示介于CK5(红色)与SMA(绿色)二者之间的中间色(黄色)[4]。它反映的是CK5由强到弱,SMA由弱到强的过程。它存在于正常乳腺及所有导管内增生性病变中。与腺中间细胞不同,它位于正常TD/DTL及增生性病变的外层或近基膜侧。
肌上皮终端细胞(myoepithelial end cell):仅表达SMA(或其它肌上皮标记)。它存在于正常乳腺TD/DTL和增生性病变的外层或近基膜侧,不见于乳腺微腺性腺病和浸润癌。
定向干细胞的分化过程可用图1表示如下。
值得注意的是:①乳腺大汗腺化生细胞和柱状细胞变的柱状细胞均不表达CK5和CK34βE12[1,6,10];②不典型导管增生(atypical ductal hyperplasia,ADH)和导管原位癌(ductal carcinoma in situ,DCIS)均不表达CK5和CK34βE12,小叶性不典型增生和小叶原位癌的细胞不表达CK5,但表达CK34βE12;③有作者发现,仅表达CK5/6的现象,只出现在常规石蜡切片中,在同组织的冷冻切片中不出现,并因此对认定仅表达CK5/6的细胞即为定向干细胞的说法表示怀疑[13]。
2 关于增生和导管内增生
增生(proliferation,hyperplasia)是指细胞数量增多引起相应组织的增大,导管内增生是指TD/DTL内上皮细胞增多和TD/DTL的增大。以往把TD/DTL壁衬覆上皮细胞≥3层作为判断有增生的标准,并重视局部细胞增生向管腔内突入或充填管腔的组织学构型(architecture)变化,例如普通性增生的细胞桥、细胞簇、真乳头和实性细胞团;不典型增生/原位癌的实性细胞团、筛状细胞团、微乳头、细胞拱桥和罗马桥等,且依上述特点结合细胞形态制订出不同增生病变的诊断标准。
但现已确认,上皮细胞增生可不显示衬覆上皮细胞层次的增多,而仅表现为单层(腺)上皮细胞衬覆增大的TD/DTL;或虽有细胞层次增加,但不形成明显的突入或充填管腔的构型变化,保持衬覆细胞平坦的复层状,TD/DTL的固有管腔保存。例如平坦型上皮不典型病变。对此类病变的判断不能沿用以往的诊断标准。
TD/DTL内增生依然可被分为导管性(ductal)和小叶性(lobular)2大类,但其内涵已不再是当初的不同解剖组织部位起源的概念,而仅是表达两者在细胞学、组织构型和免疫表型上有不同。因此,不管字面上如何描述,其实际含义均应为导管型(ductal type)和小叶型(lobular type)增生。
有意义的细胞增生是诊断增生性疾病/病变的必需条件。细胞增多受细胞增殖和细胞丢失(例如凋亡)两方面的影响。当增殖占优势时细胞数量增加。增殖指数(PI)和核分裂象指数(MI)有助于判断细胞增殖活性。然而,细胞增殖可以是非肿瘤性的或肿瘤性的,不同疾病/病变的增殖活性差异很大。在认清不同性质增生的细胞学、组织构型、甚至免疫表型的基础上,PI和MI可以成为诊断不同的TD/DTL内增生病变及判断预后的有效参数。Bálvi等[12]发现,MIB1增殖分数在正常乳腺、普通性导管增生(usual ductal hyperplasia,UDH)与低级DCIS有明显差异,分别为1.83、2.41及8.4。
3 关于UDH
目前认为,UDH是一种良性导管增生性病变,不列入导管上皮内肿瘤(ductal intraepithelial neoplasia,DIN)系列[1]。其本质是一种“定向干细胞病变”[4],或者说是一种以定向干细胞及其分化的腺中间细胞和腺终端细胞为主,杂有肌上皮中间细胞和肌上皮终端细胞乃至大汗腺细胞的增生性病变[4~12]。
这种新认识,既可解释UDH的细胞学特征,如多种细胞、(腺性)上皮细胞及其细胞核的多样性和无不典型性等;也可解释其组织构型,如细胞(核)的流水状或漩涡状排列及大小、形态不一、边缘参差、裂隙样窗孔等;并为通过免疫组化检测协助UDH诊断及与ADH/DCIS鉴别提供了理论依据。
一系列的研究证实,UDH显示高分子量CK呈拼花状或弥漫性阳性。由于总是有腺终端细胞及肌上皮终端细胞的存在,因此在相应部位会显示低分子量CK,如CK8/18/19阳性及SMA阳性。简而言之,在免疫组化检测时,UDH显示CK5或CK34βE12与CK8/18/19的镶嵌式阳性表达;在免疫荧光双标中,它显示绿(CK5)、黄(CK5及CK8/18/19)和红(CK8/18/19)的色彩并存。SMA阳性的肌上皮细胞总存在于外周部位(图2~6)。
值得注意的是:①应用免疫组化结果解释增生性病变时,HE图像依然是诊断和鉴别诊断的基础。②在不同增生性病变中,CK5和CK34βE12的阳性表达或不表达,均非100%(表1),而且CK5与CK34βE12之间并不完全一致。③要注意CK5或CK34βE12阳性细胞的强度及数量。在1型ADH和以1型ADH量化(总横切面直径>2mm)诊断的DCIS中,由于有少量正常小管上皮或UDH的存在,可能出现少量的CK5或CK34βE12阳性表达。在UDH中,因为有腺终端细胞和(或)大汗腺上皮及柱状细胞的存在,CK5和CK34βE12可出现灶性阴性。④CK5和CK34βE12的阳性表达,不会改变高(核)级DCIS的HE诊断。因为高(核)级DCIS可以直接发生并不经过ADH。此外,在高(核)级DCIS发生导管内扩散形成导管内扩散癌(intraductal spread carcinoma,ISC)时,其原有导管或增生的导管上皮依然可以表达CK5及CK34βE12。
表1 CK5、CK34βE12在不同TD/DTL内增生病变中的表达[10]
CK UDH(%) ADH(%) DCIS(%) LCIS(%)
34βE12 +++(90~100) -/+(80~90) -/+(81~100) +++(80~100)
5/6 +++(88/100) -/+(80/92) -(96~100) -(83~100)
值得一提的是,UDH的窗孔习惯上称为次级或二级管腔,其实这是一种误解。它是导管/小管固有腔或“一级”管腔被增生细胞分隔的结果。在横切面上它们似乎与固有管腔不通,但从立体观察,均与“一级”管腔相通。这是它与低级DCIS的“筛孔”不同之处,后者是新的肿瘤性管腔。识别这些腔的不同特征(图7),有助于鉴别诊断。
4 关于不典型性和不典型增生
不典型性(atypicality)或异型性(atypia,atypism)是指肿瘤在组织学和细胞学方面与其相应正常组织间存在的差异。这种差异可表现为组织学构型的变异、细胞的多形性和核的异型。尽管异型性的大小在不同肿瘤可以差异很大,自很轻微到很明显,但它的有或无却是区别良性增生和肿瘤性增生的重要依据,尤其是明显的细胞多形及核异型常是诊断恶性肿瘤的形态学依据。然而在乳腺经典型小叶性肿瘤和低(核)级导管内增生性病变中,细胞的单一性(monotonous)和一致性(uniform)及轻微的核/质比例增大,却是最突出的细胞学不典型性;而细胞分布的均匀性及一些特殊组织学构像则是其特征性的组织学异型性。这两者的结合是诊断和鉴别诊断的依据。
1985年,Page等[15]在对仅做过乳腺活检、经长期随访的10542件标本进行回顾性研究后指出:在原位癌(carcinoma in situ,CIS)和无原位癌特征的上皮增生之间,存在着一类“具有CIS的部分但不是全部特征的病变”,他称之为不典型性增生(atypical hyperplasia,AH),包括不典型性“导管”增生(atypical ‘ductal’ hyperplasia,ADH)和不典型性小叶性增生(atypical lobular hyperplasia,ALH)。但与此前一些病理学家(包括Page本人)使用AH,在该文中Page把AH严格限定在:①具有CIS的部分但不是全部(缺少任何1项)特征的(低核级)增生性病变;②具有(低核级)DCIS全部特征,但范围仅限于1个管腔或不足2个分隔的管腔的“导管性”增生性病变;或具有LCIS特征但累及范围未达到小叶大部分小管的小叶性病变。
1999年,Tavassoli等[2]把ADH分为两型:1型,单一的不典型的细胞增生显示典型UDH的任何构型(图8),或单一性细胞灶性聚集混杂有UDH;2型,纯粹由单一的不典型细胞组成,并显示1种或多种经典DCIS的构型,但仅累及单个管腔的一部分,或累及多个TD/DTL而其合计横切面的直径<2mm(图9,10)。笔者理解:ADH1型为质不纯,ADH2型为量不足。Tavassoli认为,如果在ADH2型中出现坏死,则应视为DCIS。2001年,Rosen[3]指出,无论是Page还是Tavassoli,诊断ADH的量化标准都是人为的。因为没有关于累及1个、2个、3个导管的横切面,或病灶直径为1.5、2.0、2.5mm的比较研究的报道。
2003年WHO乳腺肿瘤分类中[1]将ADH定义为“一种肿瘤性导管管内病变以均匀分布的单形性细胞为特征,伴有中度进展为浸润癌的风险”,其形态学特征为“通常具有卵圆形或圆形核的单形性细胞增生,细胞分布均匀,可形成微乳状、簇状、茎状、拱形、僵硬的桥状、实体状和筛状等构形,其细胞学相当于低级DCIS。”该分类指出:当特征性细胞和UDH共存和(或)当经典性形态部分地累及TDLU时,均可诊断为ADH。前一种情况与Tavassoli的ADH1型相同,后一情况则比Page或Tavassoli的说明更模糊。至于是否采用量化标准以区别ADH与低级DCIS,该分类指出“目前尚未形成共识”,并同时列出了Tavassoli和Page的各自标准。这意味着,至少在近期内,在HE染色片内如何区别ADH与低级DCIS会形成标准不一的局面。笔者赞同Tavassoli的量化标准。
2004年,Koerner[5]指出,Page对AH的概念是正确的,但定义却是模糊的,因为它既未指明哪些是AH必需有的特征,哪些是可以缺少的特征。Koerner主张把ADH定义为“显示低级细胞学不典型性但缺乏有意义的组织学构型不典型性的导管性增生”。笔者理解,Koerner的定义近似于Tavassoli的ADH1型,但Koerner不倾向于使用Page或Tavassoli的量化标准,而宁愿把诊断建立在纯形态学发现上,将此类病变作为独立属性的病灶来描述其大小。对不符合Page或Tavassoli量化标准的病变,称之为“显微镜下导管原位癌灶(microscopic focus of ductal carcinoma in situ)”。笔者认为,使用该诊断宜慎,因为可能引起治疗过度。
与UDH相反,90%的ADH不表达CK5/6、CK34βE12或CK5/14。通过采用免疫组化或免疫荧光标记以检测上述标记物,可区别UDH与ADH,但不能区别ADH与低级DCIS。ADH不表达p53,罕见表达c2erbB22,27%~59%显示cyclinD1过表达。
应当注意:①2mm的阈值不适用于TD/DTL纵切面病变;②ADH1型因杂有UDH成分,所以它在相应部位可以表达CK5/6、CK34βE12或CK5/14,但在不典型细胞区应为阴性;③ADH2型对CK5、CK34βE12基本不反应;④在HE结合免疫组化仍难以区分ADH与低级DCIS时,宜偏向ADH;⑤应提醒临床医师,ADH患者适合行包括肿块在内的区段切除术及随访。单就ADH本身并不是切除乳房的适应症。
5 关于DCIS
目前认为,DCIS是一种肿瘤性导管内病变,特征为上皮细胞明显增生,细胞有轻至重度异型,有发展为浸润癌的趋势,但并非必然。它是一组在表现模式、组织病理学形态、生物学特征和发展为浸润癌等方面均呈高度异质性的病变。
Koerner[5]认为,低级DCIS体现肿瘤性腺形成细胞(neoplastic gland forming cells)的增生。正因为如此,此种癌细胞具有重演腺或小管结构倾向,并有细胞间黏附性降低,从而产生了低级DCIS的构型和细胞学特征。
与正常腺上皮细胞相仿,低级DCIS癌细胞也可显示细胞极化(cellular polarization)现象。所谓细胞极化现象,是指细胞的亚细胞区(subcellullar regions)呈现不同形态和功能的有机组合状态。例如腺上皮极化,表现为细胞核位于细胞的近基膜区(基极basal pole),胞质聚集于核的对侧端(顶极apical pole),形成顶部胞质区(apical cytoplasmic compartment)。低级DCIS中具有极化现象的癌细胞可形成新的腺腔。当肿瘤细胞团内出现大量新腺腔时,镜下其横切面可见大量形态一致、圆形、冲凿状的空腔,腔间为大量均匀分布、形态单一的癌细胞,使癌细胞团呈筛状,习惯上称这些腔为筛孔。筛状结构是低级DCIS组织构型的不典型性表现之一,其它如小梁性栅栏状(trabucular bar)、银币状(cartwheel formations)以及罗马桥状(Roman bridges)等构型均为筛状结构的变型,都与肿瘤细胞的极化现象有关。
单一的细胞及其核的均匀性分布是低级DCIS的另一个组织构型不典型性的表现。这种特点在辨认微乳状及实体型低级DCIS时有着重要的意义。
低级DCIS的细胞学不典型性表现为:胞界清楚,胞质苍白或嗜伊红染细颗粒状,核形规则,轮廓平滑,呈圆形或卵圆形,染色深,核仁极罕见。
Koerner的总结性意见为:UDH既无细胞学也无组织构型不典型性,ADH有细胞学不典型性但无组织构型不典型性,低级DCIS具备细胞学和组织构型的双重不典型性。对于具备明显细胞学不典型的病变即归入高级DCIS,此时可以不顾及其它特征。
DCIS对CK5或CK5/6、CK34βE12均不表达,仅表达CK8/18/19(图11~15);42%~60%表达c2erbB22,其中粉刺型DCIS69%阳性,非粉刺型18%阳性,微乳头型和筛状型常阴性[3];10%~37%DCISp53阳性,主要见于高级或粉刺型,低核级DCIS罕见阳性;E2cadherin对鉴别实体型低级DCIS与LCIS有价值,前者阳性,后者阴性。
2002年,Megha等[16]依据免疫组化检测结果把DCIS和IDC分为2种表型:①干细胞表型(stem cell phenotype),表达CK8、CK14、CK18、vimentin、EGFR和p53,不表达bcl22、ER和PR。13例中,差分化9例,中分化4例。②腔细胞表型(luminal cell phenotype),表达CK8、CK14,少数表达CK18,不表达vimentin和EGFR,p53多数为阴性,但bcl22、ER和PR表达。38例中,31例为中分化,7例为高分化。MIB1增殖细胞数在2个表型间差异明显,在干细胞表型分别为DCIS 63.5%、IDC 69%,在腔细胞表型DCIS为19.6%、IDC为18.9%。
图1 乳腺上皮细胞分化的假设模式图[4]
图2 UDH,细胞形态多样,可见形态不规则及裂隙样空腔(窗),左侧小管中央部有少数小细胞,核深染
图3 UDH,同上例,小管中央部CK5呈拼花样阳性,强弱不等,S2P法
图4 UDH,同上例,左侧小管中央部CK34βE12强阳性,周边部及右侧小管呈中~弱阳性,S2P法
图5 UDH,同上例,CK8呈弥漫性强阳性,杂有弱阳性及阴性细胞,S2P法
图6 UDH,同上例,小管周边部SMA强阳性,右侧小管内散在少数细胞阳性,S2P法
图7 导管内增生性病变不同形态的腔管模式图[14]旺炽型UDH的腔呈不规则形、裂隙状,腔缘不整,其间细胞核可呈漩涡状,ADH可有UDH及DCIS两者的腔;DCIS腔圆、冲凿状,其间细胞单一,分布均匀。
图8 ADH1型,小管中央部单一小细胞,核小、深染、形态单一,核长轴与腔垂直,呈不典型筛状,周边部为单层至复层细胞
图9 测量病变小管直径模式图[2]左图示TDLU内2个筛状小管,总横切面直径<2mm;右图示TDLU内2个筛状小管,总横切面直径>2mm
图10 测量病变小管直径模式图[2]示明显展开的小管呈筛状构型,细胞单一,病灶横切面直径>2mm[2]
图11 低级DCIS,左下为低级DCIS灶,呈拱状,细胞小、单一,中部为UDH,右侧有一TDLU,部分小管UDH
图12 同上例,左下低级DCIS灶CK5阴性,右侧TDUL呈灶性阳性,S2P法
图13 同上例,左下低级DCIS灶,CK34βE12阴性,中部UDH及右侧TDLU呈灶性阳性,S2P法
图14 同上例,左下低级DCIS灶及中部UDHCK8弥漫阳性,右侧TDLU大部分小管呈中等阳性,少数阴性,S2P法
图15 同上例,左侧1个低级DCISSMA表达不明显,余均见强表达,S2P法

名称:图1
描述:图1

名称:图2
描述:图2

名称:图3
描述:图3

名称:图4
描述:图4

名称:图5
描述:图5

名称:图6
描述:图6

名称:图7
描述:图7

名称:图8
描述:图8

名称:图9
描述:图9























