| 图片: | |
|---|---|
| 名称: | |
| 描述: | |
- 看大体猜诊断--胸壁肿物-皮隆突(已确诊)(4)
隆突性皮肤纤维肉瘤的病理特点及其鉴别诊断
杨连君 (白求恩国际和平医院病理科,石家庄 050082)
关键词:皮肤纤维瘤;肉瘤;病理;诊断
中图分类号:R739.5 文献标识码:B
隆突性皮肤纤维肉瘤(dermatofibrosarcoma protuberans, DFSP)是经典的中间型(交界性)纤维组织细胞肿瘤的代表。由于DFSP易局部复发,也常被称为恶性潜能未定的潜在低度恶性肿瘤。DFSP的浸润生长能力很低,极少发生转移,因此不是真正的恶性肿瘤[1, 2]。1890年Taglor首次报道此病。1924年Darier等将其描述为“进行性复发性真皮纤维瘤”。1925年Hoffmann将其命名为DFSP。在临床上DFSP并不非常罕见,但是常易被误诊为良性肿瘤而做一般性的切除处理,往往导致其复发,有的甚至转化为真正恶性的纤维肉瘤或恶性纤维组织细胞瘤而难以彻底切除[3]。因此,DFSP的早期诊断非常重要,但是其诊断没有可靠的影像学检查等辅助手段,只能依靠病理诊断来确诊[4, 5]。
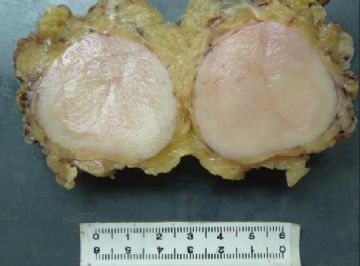
1 肉眼所见
DFSP好发于青壮年,男性稍多于女性,病变部位主要是躯干和四肢近侧端的真皮组织,临床表现为无痛性持续缓慢生长的单个结节,呈隆起状、瘢痕样或斑块状,个别报道见有多结节融合成分叶状的。瘤体大小不一,直径约为0.5-12 cm,切面灰白,无包膜,边缘尚清,不与筋膜和肌肉组织粘连[6]。如果单纯地根据其生长缓慢,境界清晰,表皮完整,早期活动度好,以及患者自觉一般状况良好等情况,很容易把DFSP主观地误诊为良性肿瘤[7]。临床上一旦发现位于躯干和四肢近侧端的隆起于皮肤的或呈淡红、淡兰紫色的无痛性质硬结节,就应该考虑到可能是DFSP[8]。
2 显微结构
DFSP的瘤细胞较为丰富,呈梭形,大小形态较一致。瘤细胞和胶原纤维常呈席纹状、轮辅状、编织状、旋涡状或束状排列。上述比较特殊的细胞排列方式有助于DFSP的鉴别诊断,但是它们并非是DFSP所特有的,不能单独作为确诊依据[9]。在DFSP中很少见或没有巨细胞、黄色瘤细胞、泡沫细胞、炎症细胞和出血坏死。当瘤体较大时,DFSP的组织结构和形态变化并不均一。在其瘤体浅表层,瘤细胞在胶原纤维间分散排列,相似于真皮纤维瘤。肿瘤可浸润到表皮下或留有一个未受累的表皮带,其上方的表皮一般没有增生,常萎缩变薄。DFSP的瘤细胞虽然局灶丰富,可见轻度异型和个别核分裂像,但是没有明显的异型性,只是出现了形态转化的交界性病变,缺乏明确的恶性特征而不能诊断为肉瘤。目前从组织病理上一般可将DFSP分为普通型、粘液型、纤维瘤型、黑色素型、巨细胞纤维母细胞瘤样型、萎缩型和混合型等多种类型[6]。由于DFSP的组织结构通常不典型,并且在较重或复发的DFSP中常见形态多样性,其病理诊断,尤其是早期确诊,是比较复杂和困难的。
3 分子标记
在DFSP的病理诊断中,组织学特点和临床资料是主要的依据,免疫组织化学有助于鉴别诊断。在免疫组化染色中,DFSP瘤细胞对波形蛋白(Vimentin)呈强而弥漫性的阳性反应;CD34一般呈强而弥漫性的阳性反应,阳性率为72-92% [10, 11]。溶菌酶(Lysozyme)呈局灶性阳性反应;平滑肌肌动蛋白(SMA)在DFSP的表达阳性率为50-95%,但是其表达常不稳定并且常呈局灶性[12-14]。
4 鉴别诊断
4.1 真皮纤维瘤 发生于真皮组织的纤维瘤的瘤细胞也呈梭形,并可有旋涡状、车辐状或束状排列等与DFSP类似的组织结构。真皮纤维瘤单发或多发均有,多发生于四肢各部位,常有炎细胞、多核巨细胞和含铁血黄素等多种成分,并且表皮组织常增厚;而DFSP多为单发,多见于躯干和四肢的近侧端,成分比较单一,表皮常萎缩变薄。纤维瘤中CD34呈散在或局灶的弱阳性,SMA呈阴性;而DFSP的CD34表达一般较强,SMA的阳性率也比较高[15]。
4.2 神经纤维瘤 神经纤维瘤也可发生于DFSP的好发部位,其瘤细胞也为梭形,并且可呈CD34阳性。但是神经纤维瘤的瘤细胞呈波浪状、细胞核弯曲,瘤组织可形成触觉小体样结构,一般为S-100蛋白表达阳性,并且在手术后经常会发现其与较大的神经束支有关[16]。
4.3 韧带样纤维瘤 韧带样纤维瘤的边界不清,常向周围组织浸润,可使其周围的横纹肌组织发生萎缩和变性,镜下胶原纤维成分特别丰富,并可见多核巨细胞。而DFSP的胶原纤维成分相对较少,并且一般不会有多核巨细胞。
4.4 纤维肉瘤 纤维肉瘤常从深层软组织开始发生,其瘤细胞较肥胖,细胞核大,核仁明显,可见较多的包括病理性核分裂的核分裂像,并且常有人字形结构和出血坏死。
4.5 良性纤维组织细胞瘤 普通的纤维组织细胞瘤的体积一般较小,不仅细胞类型多样,还含有含铁血黄素等多种成分,并且其好发部位也与DFSP不同。
4.6 恶性纤维组织细胞瘤 恶性纤维组织细胞瘤的瘤细胞具有明显的多形性和异型性,核分裂像常见,尤其是病理性核分裂多见,具有杜顿巨细胞、黄色瘤细胞和炎症细胞等,并且常见出血坏死。
4.7 黏液型脂肪肉瘤 当DFSP发生黏液变时,需与黏液型脂肪肉瘤鉴别。DFSP位置相对表浅,瘤体结实,血管增生但不连结成网,缺乏分化程度不同的脂肪母细胞,这些特点都有助于其与脂肪肉瘤鉴别,并且脂肪肉瘤的发病部位常在皮下和深部软组织。
4.8 皮肤平滑肌瘤 皮肤平滑肌瘤在临床上比较少见,主要表现为疼痛性的多发性肿块[17]。瘤组织主要由分化好的大片增生的平滑肌细胞和平滑肌束组成。平滑肌束呈粉红色,细胞核呈梭形棒状、两端圆钝,细胞浆丰富、红染。皮肤平滑肌瘤分为3型[18]:①单发性血管平滑肌瘤。此型最常见,约占皮肤平滑肌瘤的80%以上,有包膜,发生于血管壁的平滑肌,由分化好的平滑肌细胞和大量丰富的厚壁小血管组成,并且血管壁和肿瘤的平滑肌之间有移行;②单发性肉膜性平滑肌瘤,即发生于阴囊、乳头、乳晕或大阴唇皮下肉膜肌的平滑肌瘤;③多发性皮肤平滑肌瘤,起源于立毛肌。肉眼见大范围的多发性皮疹,有的融合成片,由于平滑肌痉挛常导致剧痛。SMA免疫组化无助于DFSP与平滑肌瘤的鉴别,因为SMA在DPSP也常呈阳性。一部分皮肤平滑肌瘤难以判断良恶性,通常称为恶性潜能未定的、中间型或交界性平滑肌瘤。交界性平滑肌瘤与DFSP的预后相似,在二者不易鉴别时不管是诊断前者还是后者,都可提示该肿瘤可能复发或恶变,对于临床治疗方案没有明显的影响[19]。
4.9 结节性筋膜炎 结节性筋膜炎的肿块常界限不清,体积较小,有短期内迅速增大史。其纤维母细胞成分排列杂乱、稀疏,胶原纤维少,基质粘液水肿,并可见炎细胞浸润。而DFSP以排列紧密的单一形态纤维母细胞为主构成,体积相对较大,很少见炎细胞。
5 组织起源
电子显微镜观察和免疫组化检测显示,DFSP中可有纤维母细胞、肌纤维母细胞、树突状细胞、神经周雪旺氏鞘细胞、组织细胞、平滑肌细胞、纤维细胞和原始间叶细胞等多种成分。在不同病例中,虽然各种细胞成分多少不一,但是大多数是幼稚间叶细胞,所以目前一般认为DFSP来源于多潜能分化的原始间叶组织干细胞,可将其视为特殊类型的皮肤交界性梭形细胞型纤维组织细胞瘤[20]。
6 临床预后
作为恶性潜能未定的中间型肿瘤,DFSP的恶性程度介于纤维瘤和纤维肉瘤之间,只具有局部侵袭性,极少发生转移。由于DFSP的临床症状和病理表现不典型,常易被误诊为良性肿瘤,通常在门诊做一般性的局部手术切除,甚至不做病理检查而导致漏诊[21]。有调查显示DFSP的临床误诊率高达90%以上[8]。在错误地采取了单纯的局部切除术后,大多数DFSP会复发,也常在复发之后才能得到正确的诊断。DFSP复发后的分化程度较原发灶差,可见部分区域呈黏液变性,纤维肉瘤样、毛细血管瘤样、恶性纤维组织细胞瘤和黑色素瘤样结构,病变逐渐趋向于典型的恶性转化,并且常呈多灶性,向纵深生长,转移发生率大为增高,所以早期诊断和根治是预防复发,避免转移的关键[22]。DFSP的治疗原则通常是进行局部扩大切除,但是不必做预防性淋巴结清除术。有研究显示,当肿块距切缘2 cm以下时,无论切缘肿瘤切净与否,DFSP均可发生复发。DFSP发生复发与手术切除范围过小有关,而与病人的年龄、性别、发病部位、肿瘤的体积大小及核分裂像的多少无明显关系[8]。DFSP复发后因治疗困难所带来的巨大损失成为极为棘手的问题。为了提高DFSP的早期确诊率和预后评价的准确性,有必要对其病因学、组织学起源和分子生物学行为进行深入研究[23]。
参考文献:
[1] Mendenhall WM, Zlotecki RA, Scarborough MT. Dermatofibrosarcoma Protuberans [J]. Cancer, 2004, 101(11): 12503-12508.
[2] Sinovich V, Hollowood K, Burge S. Atrophic dermatofibrosarcoma protuberans [J]. Australas J Dermatol, 2005, 46(2): 114-117.
[3] Swan MC, Banwell PE, Hollowood K, et al. Late recurrence of dermatofibrosarcoma protuberans in the female breast: a case report [J]. Br J Plast Surg, 2005, 58(1): 84-87.
[4] 王岚, 沈尊理, 贾万新, 等. 皮肤隆突性纤维肉瘤的治疗与复发[J]. 实用医学杂志, 2003, 19(10): 1116-1117.
[5] Resnik KS, DiLeonardo M, Hunter CJ, et al. Pedunculated presentation of dermatofibrosarcoma protuberans [J]. J Am Acad Dermatol, 2003, 49: 1139-1141.
[6] 刘孟忠, 王修身, 蔡玲, 等. 74 例隆突型皮肤纤维肉瘤的治疗与预后分析[J]. 中华肿瘤杂志, 2005, 27(2): 122-125.
[7] Oliveira-Soares R, Viana I, Vale E, et al. Dermatofibrosarcoma protuberans: a clinicopathological study of 20 cases [J]. J Eur Acad Dermatol Venereol, 2002, 16(5): 441-446.
[8] 孙凤平, 叶春辉, 潘萍. 22例隆突性皮肤纤维肉瘤临床病理分析[J]. 实用肿瘤杂志, 2000, 15(4): 271-172
[9] 宦大为, 王翠芳, 李铭钟, 等. 隆突性皮肤纤维肉瘤临床病理分析[J]. 沈阳医学院学报, 2003, 5(1): 29-31
[10] Kahn HJ, Fekete E, From L. Tenascin differentiates dermatofibroma from dermatofibrosarcoma protuberans: comparison with CD34 and factor XIIIa [J]. Hum Pathol, 2001, 32(1): 50-56.
[11] 罗燕, 邱丙森. CD34抗原表达在皮肤纤维瘤和隆突性纤维肉瘤鉴别诊断中的意义[J]. 上海医学, 2000, 23(3): 177-178.
[12] 邱建龙, 黄种心, 王莉莉, 等. 隆突性皮肤纤维肉瘤临床病理及免疫组化观察[J]. 河南肿瘤学杂志, 2001, 14(5): 318-320.
[13] 郭立新, 杨光华, 姜勇, 等. 肌样型隆突性皮肤纤维肉瘤中肌样区域的组织发生和性质[J]. 临床与实验病理学杂志, 2004, 20(2): 131-135.
[14] 陈燕. 隆突性皮纤维肉瘤病理诊断及误诊5例分析[J]. 中国误诊学杂志, 2002, 2(1): 117-118.
[15] Li N, McNiff J, Hui P, et al. Differential expression of HMGA1 and HMGA2 in dermatofibroma and dermatofibrosarcoma protuberans: potential diagnostic applications, and comparison with histologic findings, CD34, and factor XIIIa immunoreactivity [J]. Am J Dermatopathol, 2004, 26(4): 267-272.
[16] Kovarik CL, Hsu MY, Cockerell CJ. Neurofibromatous changes in dermatofibrosarcoma protuberans: a potential pitfall in the diagnosis of a serious cutaneous soft tissue neoplasm [J]. J Cutan Pathol, 2004, 31(7): 492-496.
[17] 张秀英, 兰东, 佟春光, 等. 皮肤平滑肌瘤1例[J]. 临床皮肤科杂志, 2004, 33(4): 226-227.
[18] 刘毅钧, 张淑英, 李景云, 等. 多发性皮肤平滑肌瘤1例报告[J]. 中国皮肤性病学杂志, 2002, 16(1): 47-48.
[19] 黄晓赤, 罗克枢, 赵剑萍. 皮肤交界性平滑肌瘤的复发与恶性转化[J]. 临床与实验病理学杂志, 2004, 20(5): 585-587.
[20] Zamecnik M, Michal M. EMA+ cells in dermatofibrosarcoma protuberans. A study of 11 tumors suggesting perineurial cell differentiation [J]. Cesk Patol, 2002, 38(2): 55-62.
[21] 王配合, 杨建民, 孙志刚, 等. 误诊为瘢痕的皮肤隆突性纤维肉瘤[J]. 临床误诊误治, 2005, 18: 453-454.
[22] 李祥周, 刘英娜, 张佃乾, 等. 隆突型皮肤纤维肉瘤复发与转移的临床病理研究[J]. 中华肿瘤杂志, 1997, 18: 278-.
[23] West RB, Harvell J, Linn SC, et al. Apo D in soft tissue tumors: a novel marker for dermatofibrosarcoma protuberans. Am J Surg Pathol, 2004, 28: 1063-1069.

- 广州金域病理
| 以下是引用天山望月在2009-10-10 15:54:00的发言:
隆突性皮肤纤维肉瘤的病理特点及其鉴别诊断 杨连君 (白求恩国际和平医院病理科,石家庄 050082)
|
|
隆突性皮肤纤维肉瘤的病理特点及其鉴别诊断 杨连君 (白求恩国际和平医院病理科,石家庄 050082) |

- 勤学善思
| 以下是引用天山望月在2009-10-10 15:54:00的发言:
隆突性皮肤纤维肉瘤的病理特点及其鉴别诊断 杨连君 (白求恩国际和平医院病理科,石家庄 050082) |

- 只要你的脚还在地面上,就别把自己看得太轻;只要你还生活在地球上,就别把自己看得太大









 学习了
学习了